서 론
유엔식량농업기구(United Nation’s Food and Agriculture Organization, FAO)에 따르면 세계 인류가 2050년까지 약 90억 명에 달할 것으로 예측된다(Tao & Li, 2018). 이러한 인구의 증가 및 기후 변화에 따른 식량 생산의 변화로 세계 인구 중 2억 명 이상이 식품 불안정(food insecurity) 상태에 놓여 있는 것으로 나타난다(Adegboye et al., 2021).
식품 불안정은 건강을 유지하기 위한 식품을 구매하거나 섭취할 수 없는 상태를 의미하며, 이를 낮추기 위한 다양한 방안들이 논의되고 있다(Verneau et al., 2021). 다양한 방안들 중 하나로, 단백질에 대한 섭취를 증가시키는 방법인 대체 단백질이 주목받고 있으며, 그 중에서도 특히 단백질이 풍부한 개체인 곤충의 활용을 통해 이를 극복하고자 하는 방안이 제시되고 있는 상황이다(Smolinski et al., 2015).
곤충 단백은 기존의 단백질 영양공급원인 소, 돼지 등에 비해 1 kg을 생산하는 데 약 2 kg의 사료만 소모될 만큼 생산 효율이 매우 높고 또한 생산 시 발생하는 온실가스나 암모니아 배출도 매우 낮기 때문에 영양적 측면과 환경적 측면을 모두 고려하였을 때, 미래의 식량 자원으로 이용 가치가 높다(Park & Yun, 2018). 그러나 곤충 단백의 경우 곤충 자체가 가지고 있는 특이한 향과 맛, 그리고 곤충의 생김새에서 오는 거부감 등으로 섭취하기를 꺼려하는 경우가 많아, 가공 등을 통해 이를 해소하기 위한 노력이 지속되고 있다(Gravel & Doyen, 2020). 현재 우리나라에서 식품의약품안전처로부터 식용을 공식적으로 인정받은 곤충은 총 10종으로, 갈색거저리 유충 및 쌍별귀뚜라미 역시 이들 10종 중에 포함된다(식품의약품안전처, 2025).
갈색거저리 유충(Tenebrio molitor)은 단백질(약 47∼60%), 지방, 필수아미노산, 불포화 지방산이 풍부하며, 사육 기간이 약 2∼3개월로 짧고, 사료효율(Feed Conversion Ratio, FCR)이 2.2∼2.7로 기존 가축에 비해 우수하여 산업적 대량생산에 적합하다(Kim et al., 2019). 쌍별귀뚜라미(Gryllus bimaculatus)는 단백질(55∼70%), 지방, 키틴, 미네랄이 풍부하고, 약 5∼7주 만에 수확이 가능하며, FCR이 1.7∼2.9로 매우 효율적이다. 또한 사육 공간과 환경 부하가 적어 경제성과 지속가능성이 높다(Belluco et al., 2013). 갈색거저리 유충과 쌍별귀뚜라미 모두 온실가스 배출, 수자원 및 토지 사용량이 기존 축산에 비해 현저히 낮고, 다양한 식품 소재로 활용할 수 있어 미래 식량원으로서의 잠재력이 크다(van Huis, 2013).
곤충 단백을 가공하는 방법 중의 하나로 효소를 첨가한 가수분해물 형태의 이용이 지속적으로 연구되고 있으며, 이를 통해 항산화 활성 등의 기능성이 확인되고 있다(Jang et al., 2019). 뿐만 아니라 곤충 단백의 제조 방법에 따른 물리화학적 특성에 대한 연구(Son & Hwang, 2017) 등 식품에 사용할 수 있는 소재로서의 연구(Baek et al., 2022)도 지속되고 있다.
본 연구는 미래 식량 자원으로 주목받고 있는 곤충 단백을 활용하기 위해, 갈색거저리 및 쌍별귀뚜라미 분말을 대상으로 반응표면분석법(Response Surface Methodology, RSM)을 이용하여 효소 반응이 일어나는 최적 조건을 확립하고자 하였다. 반응표면분석법(RSM)은 여러 독립변수와 종속변수 간의 상관관계를 통계적으로 분석하여 공정의 최적 조건을 도출하는 실험계획법으로서, 식품 가공의 추출·발효 등 다양한 단위 공정 최적화에 널리 활용되고 적은 실험으로도 효율적인 모형 구축이 가능하다는 장점이 있다(Kim et al., 2020). 최근에는 갈색거저리와 쌍별귀뚜라미 등 식용 곤충을 활용한 단백질 추출 및 효소 가수분해 공정에도 이 기법이 도입되고 있다. 예를 들어, 갈색거저리 유충을 산처리하여 아미노산을 추출하는 공정에 RSM을 적용함으로써 최고 수율을 얻기 위한 최적 조건을 도출한 연구가 보고되었고(Szopa et al., 2024), 쌍별귀뚜라미 분말의 효소적 가수분해 조건을 RSM으로 최적화하여 항산화 펩타이드 생산성을 높인 사례도 밝혀졌다(Yeerong et al., 2024). 이러한 연구 결과들은 RSM 기반의 통계적 최적화가 곤충 유래 효소 가수분해물 추출 공정의 효율화에 효과적인 도구임을 시사한다. 본 연구에서는 반응표면분석법 중 중심합성계획모델(Central Composite Design, CCD)을 실험 설계에 적용하였으며, 이를 통해 도출된 최적 조건에서의 가수분해물의 단백질 함량을 바탕으로 항산화 및 물성을 평가하고 식품 산업에서의 적용 가능성을 탐색하였다. 또한, 최적 조건에서 만들어진 곤충단백 가수분해물을 대상으로 항산화능과 물성을 확인함으로써 식품 소재로서의 적합성과 기능성을 모두 확인하고자 하였다. 이를 바탕으로 향후 식품 원료로서의 곤충단백 가수분해물의 활용도를 높이는 기초 자료로 사용하고자 한다.
재료 및 방법
본 연구에 사용한 갈색거저리 및 쌍별귀뚜라미 분말은 ㈜오엠오(Damyang, Korea)에서 구입하였으며, 각 분말은 n-hexane (Daejung, Korea) 용매를 이용하여 24시간 동안 탈지 과정을 거친 후 사용하였다. 실험에 사용된 시약들 중 항산화능 분석에 사용한 2,2-diphenyl- 1-picrylhydrazyl (DPPH)는 ㈜생물나라의 0.2 mM solution 제품을 구매하여 이용하였으며(Seoul, Korea), 2,2'-azino-bis (3-ethylbenzothiazoline-6-sulfonic acid, ABTS)는 Santa Cruz Biotechnology, Inc. (Dallas, TX, USA)에서 구입하였다. Iron (Ⅲ) Chloride hexahydrate (FeCl3 · 6H2O)를 비롯하여 따로 언급하지 않은 시약은 Sigma-Aldrich Co. (St. Louis, MO, USA)에서 구입하여 이용하였으며, 분석 시 사용한 시약들은 모두 분석용 등급을 사용하였다. 갈색거저리 및 쌍별귀뚜라미 가수분해물 제조 시에 사용한 효소는 각각 Alcalase (Novozyme, Denmark), Flavourzyme (Novozyme, Denmark)의 2종을 비율에 따라 혼합하여 사용하였다.
갈색거저리 및 쌍별귀뚜라미 분말을 이용하여 가수분해물 제조 시 사용되는 효소 추출의 최적 조건을 도출하기 위해 반응표면분석법(RSM)을 적용하였다. 본 실험에서는 반응표면분석법 중 중심합성계획모델(Central Composite Design Model, CCD)을 이용하였으며, 이를 통해 얻어진 효소 가수분해물의 최적 조건으로 예상되는 20개 조건을 바탕으로 실험을 진행하였다.
반응표면분석법(RSM)을 통해 얻은 예측 조건을 바탕으로, 해당 시간에 유리 아미노산 분석을 위한 샘플 10 mL를 채취하였으며, 95℃의 항온수조(Daihan Scientific, WB-22)에서 해당 효소의 작용을 불활성화한 후 TNBS (2,4,6-Trinitrobenzene sulphonic acid)법을 통해 유리 아미노산 그룹을 정량적으로 측정하여 분석 결과를 바탕으로 최적 조건을 확립하였다.
TNBS법은 최적 조건을 통해 생산되는 갈색거저리 및 쌍별귀뚜라미 가수분해물의 유리 아미노산 그룹 함량을 측정하기 위해 사용하는 방법으로, 0.01%(w/v) TNBS 0.25 mL에 샘플 0.5 mL를 혼합하여 37℃에서 2시간 동안 반응시킨 후 여기에 10% SDS 0.25 mL와 1N 농도의 염산 0.125 mL를 첨가하여 반응을 정지시켰다. 이후 96 well plate (Falcon, Corning, NY, USA)에 샘플을 분주하여 Microplate reader (Multiskan, Thermo Scientific, MS, USA)를 이용하여 335 nm에서 흡광도를 측정하였다. 표준물질로는 L-leucine을 이용하였으며 이를 바탕으로 표준곡선을 그려 시료 내 유리 아미노산 그룹의 함량을 측정하였다.
탈지 과정을 거친 갈색거저리 및 쌍별귀뚜라미 분말 각 50 g에 3차 증류수 450 mL를 넣고 잘 혼합한 후, 여기에 시판 효소인 Alcalase 및 Flavourzyme을 기질 대비 각각의 곤충단백 분말에 알맞은 농도로 추가하였다. 두 효소의 최적 조건인 55℃에서 반응표면분석법(RSM)을 통해 구한 농도 및 시간의 최적 조건 동안 반응을 진행하였다. 효소 반응은 50 mM phosphate buffer (pH 7.0) 하에서 수행되었으며, 반응 전 pH는 NaOH 또는 HCl을 사용하여 pH meter로 조정하였다. 반응 중 pH 변화는 buffer의 완충 능력으로 인해 유의미하게 발생하지 않았으며, 일정한 pH 하에서 효소 활성을 유지할 수 있었다. 온도의 경우 항온이 유지되는 항온 진탕배양기(Vision Science, VS310SWR) 내에서 반응을 진행하였다. 반응이 완료된 후 냉각하여 원심분리기(Hanil Science, supra-22K)를 사용하여 다음 조건(10,000 rpm, 20 min)에서 원심분리를 진행한 후 상층액만을 모아 동결건조기(Ilshin biobased, FD8512)에서 5일 동안 동결 건조시켰다. 동결 건조 후 얻은 최종 가수분해물은 초저온냉동고(–80℃)에 보관하며 실험 시마다 꺼내 사용하였다.
DPPH 라디칼 소거 활성을 측정하기 위해 Brand-Williams (Brand- Williams et al., 1995)의 방법을 변형하여 이용하였다. 양성 컨트롤로 Trolox를 이용하였으며, 0.2 mM 농도의 DPPH 시약 흡광도를 520 nm에서 측정하였을 때 1.3∼1.4의 수치가 되도록 한 후 사용하였다. 1.5 mL EP tube에 시료액을 200 µL씩 분주한 후, 여기에 DPPH 용액 800 µL를 가하여 암실에서 30분 간 반응을 진행하였다. 이후 반응액을 96 well plate에 200 µL씩 분주한 후, 520 nm에서 microplate reader를 이용하여 흡광도를 측정, 다음과 같은 식으로 라디칼 소거 활성을 계산하였다.
위 식에 의거하여 계산한 실험 결과의 추세선식을 바탕으로 %라디칼 소거 활성이 50%가 되는 지점인 IC50을 구하였다.
ABTS 라디칼 소거 활성을 측정하기 위해 Yu et al. (2017)의 방법을 일부 변형하여 이용하였다. 양성 컨트롤로 Trolox를 이용하였으며, ABTS의 최종 농도가 7 mM가 되도록 조정한 용액과 2.45 mM 과황산칼륨(Potassium persulfate)를 혼합하여 호일에 싼 후, 실온인 암소에 보관하면서 충분한 양의 ABTS+가 형성될 수 있도록 24시간 이상 방치시켰다. 이후 사용하기 전 732 nm에서 흡광도가 1.4∼1.5가 되도록 에탄올로 희석하여 조정하였으며, 조정된 ABTS 용액 950 µL에 시료를 농도별로 50 µL씩 가하여 10분 동안 암소에서 방치한 후 microplate reader를 이용하여 732 nm에서 흡광도를 측정하였다. 이후의 과정은 DPPH 라디칼 소거 활성을 구하는 방법과 동일하게 진행하였다.
FRAP을 통한 환원력을 측정하기 위해 Maksimović et al. (2017)의 방법을 일부 변형하여 이용하였다. 양성 컨트롤로 Trolox를 이용하였으며, 반응을 위한 시약은 당일 제조하였다. 300 mM acetate buffer (pH 3.6)를 만들기 위해 Sodium acetate trihydrate를 증류수에 일부 녹인 후, 아세트산으로 pH를 3.6으로 조정하였다. 이후 10 mM TPTZ (2,4,6-Tripyridyl-S-Triazine)를 증류수에 용해시킨 다음, 여기에 40 mM의 염산을 혼합하여 50℃의 항온수조에서 모두 용해시켰다. 20 mM Iron (Ⅲ) chloride hexahydrate 용액을 제조한 후 300 mM acetate buffer와 10 mM TPTZ와 염산의 혼합용액, 20 mM Iron (Ⅲ) chloride hexahydrate를 각각 10:1:1의 비율로 혼합하여 반응 용액을 만들었다. 이후 반응 용액 180 µL에 시료를 농도별로 6 µL씩 가하여 혼합하여 주었으며, 표준 용액은 Iron (Ⅲ) sulfate heptahydrate를 이용하여 0∼2 mM 범위에서 희석하여 표준 곡선을 만들어 이용하였다. 최종적으로 혼합한 용액은 10분 동안 상온에서 반응시킨 후 microplate reader를 이용하여 593 nm에서 흡광도를 측정하였으며, 이후의 과정은 DPPH 라디칼 소거 활성을 구하는 방법과 동일하게 진행하였다.
곤충단백 가수분해물의 총 폴리페놀 함량은 Folin & Denis (1912)의 방법을 변형하여 측정하였다. 시료 200 µL에 증류수 600 µL를 혼합한 후 여기에 Folin-Ciocalteu 용액 20 µL를 가하여 5분간 반응시켰다. 이후 15% Sodium carbonate 200 µL를 분주하여 1시간 동안 상온이 유지되는 암실에서 반응을 시킨 다음, 원심분리하여 상층액을 사용하였다. Microplate reader를 이용하여 760 nm에서 흡광도를 측정하였으며, 표준물질로는 Gallic acid를 사용하여 표준곡선을 작성한 후 이를 바탕으로 총 폴리페놀 함량을 측정하였다.
곤충단백 가수분해물의 과산화수소 소거 활성능은 Müller (1985)의 방법을 일부 변형하여 측정하였다. 96 well plate에 시료 20 µL와 PBS 100 µL를 혼합한 후 1 mM 농도의 과산화수소 20 µL를 가하여 37℃에서 5분간 반응을 진행시켰다. 이후 1.25 mM ABTS와 peroxidase (1 unit/mL)를 각각 30 µL 첨가한 후 다시 37℃에서 10분 간 반응시켰다. Microplate reader를 이용하여 405 nm에서 흡광도를 측정하여 아래와 같은 식으로 소거능을 계산하였다.
곤충단백 가수분해물의 용해도는 Kang et al. (2022)의 방법을 일부 변형하여 측정하였다. 시료 0.3 g을 칭량한 후, 여기에 0.1N 수산화나트륨 용액 30 mL를 넣어 용해시켰다. 이후 30분간 균질화시킨 다음 1N 수산화나트륨 및 1N 염산을 넣어 각각 pH가 1.5에서 12.0 사이의 범위가 되도록 조정하였다. 조정된 용액은 실온에서 30분 간 평형화 한 후 원심분리(10,000 rpm, 10 min)하여 상층액을 TNBS법에 따라 아미노산 함량을 정량하였다. 측정된 값은 아래와 같은 식에 대입하여 용해도를 측정하였다.
곤충단백 가수분해물의 유분흡착력(Oil Adhesion Capacity, OAC)은 Son et al. (2017)의 방법을 일부 변형하여 측정하였다. 10 mL의 콩기름을 50 mL Conical tube에 담은 뒤 여기에 곤충단백 가수분해물 분말 각 1 g을 칭량하여 가하였다. 상온에서 1시간 동안 보관하면서, 15분마다 vortexing하여 강하게 섞어 주었다. 1시간이 되었을 때, 원심분리기에서 1,600×g, 25 min의 조건으로 원심분리하였다. 이후 상층액을 제거하고 남은 잔사(residue)의 무게를 측정하여 건조 분말과 최종 잔사의 무게를 비교하였으며, 분말 1 g당 유지의 흡착력을 계산하였다.
곤충단백 가수분해물의 유화력은 Son et al. (2017)의 방법을 일부 변형하여 측정하였다. 0.1 g의 분말을 각각 측정하여 50 mL conical tube에 넣고, 여기에 25 mL의 증류수를 가하여 분산시켰다. 다시 여기에 1 mL의 콩기름을 넣은 후, 호모게나이저를 이용하여 24,000 rpm에서 1분 동안 유화액을 형성하였다. 유화액은 0.1% SDS와 1:150(v/v)의 비율로 섞은 뒤, microplate reader를 이용하여 500 nm의 조건에서 흡광도를 측정하였다. 유화력은 아래와 같은 식을 이용하여 계산하였다.
T = 탁도 계수(2.303), A0 = 흡광도(500 nm),
Ф = 대두유의 첨가량(부피, mL), C = 단백질의 분산액 부피
곤충단백 가수분해물의 단백질 소화율은 Kang & Chung (2022)의 방법을 일부 변형하여 측정하였다. 시료 2 g을 0.1N 농도의 염산 50 mL에 현탁한 후, 시료에 1% pepsin (w/w)을 첨가하여 37℃에서 2시간 동안 교반하였다. 이후 5N 농도의 수산화나트륨 용액을 이용하여 pH를 7.5로 조정하여 이를 통해 pepsin의 작용을 정지시켰으며, 이 시료에 1% pancreatin (w/w)을 첨가하여 37℃에서 다시 2시간 동안 교반하였다. 이후 상층액을 TNBS법을 이용하여 분석하였으며, 측정한 값을 이용하여 아래와 같은 식에 대입하여 단백질 소화율을 계산하였다.
곤충단백 가수분해물의 구성아미노산 및 유리 아미노산은 Kim et al. (2020)의 방법을 일부 변형하여 측정하였다. 구성 아미노산은 칭량한 시료 0.1 g에 6N 농도의 염산 5 mL를 가하여 질소가스를 충진시켜 감압 밀봉한 후, 110℃의 히팅 블록에 24시간 이상 두었다. 해당 과정을 마친 시료는 50℃에서 감압 농축기를 이용하여 산을 제거한 후, sodium dilution buffer를 사용하여 10 mL가 되도록 하였다. 이 중 1 mL를 취하여 0.2 µm의 멤브레인 필터를 이용하여 여과한 후, Table 1의 조건에 따라 아미노산 자동분석기(S433-H, Sykam GmbH, Munich, Germany)로 정량분석하였다. 아미노산 중 트립토판은 시료 1 g을 시험관에 정밀히 달아 넣고, 여기에 가용성 전분 100 mg을 가한 다음 4.2N 수산화나트륨 용액 3 mL를 가하였다. 처리를 마친 시료를 동결시킨 후, 탈기장치에 장착하여 충분히 탈기한 후 밀봉하여 135±1℃에서 22시간 동안 반응시켰고, 이후 6N 염산으로 약 10 mL로 중화하여 0.2N Sodium citrate buffer (pH 4.25)을 가한 후 Amino acid analyzer L-8900 (HITACHI, Tokyo, Japan)으로 분석하였다.
유리 아미노산 분석은 시료 2 g에 95% 에탄올 20 mL를 가하여 30℃에서 130 rpm으로 1시간 동안 추출하였다. 추출이 끝난 시료는 감압 농축기로 증류수를 제거한 후, lithium citrate buffer (0.12N, pH 2.2) 10 mL로 일정하게 하였다. 해당 용액에 sulfosalicylic acid 0.2 g을 첨가하여 4℃에서 1시간 방치하였다. 방치가 끝난 시료는 0.2 µm 멤브레인 필터로 여과하고, 이 중 1 mL를 lithium citrate buffer (0.12N, pH 2.2)와 혼합하여 적절한 농도로 희석한 후, 그 중 1 mL를 취하여 Table 1의 조건에 따라 아미노산 자동분석기(S430, Sykam GmbH, Munich, Germany)를 이용하여 정량 분석하였다.
결과 및 고찰
본 연구에서 곤충단백 가수분해물의 최적화 조건을 도출하기 위해 갈색거저리 가수분해물의 경우 Alcalase (X1, 0.2∼1.2%, w/w), Flavourzyme (X2, 0.2∼1.2%, w/w), 시간(Y, 2∼6 hr)를 각각의 독립변수로 설정하여 실험을 진행하였고, 쌍별귀뚜라미 가수분해물의 경우 시간(Y, 2∼6 hr) 조건만 다르게 하여 실험을 진행하였다. 중심합성계획법에 의해 설계된 조건에 따라 실험을 진행하여 구한 종속변수인 가수분해도(Y, µg/mL) 결과는 Table 2에 나타내었다. 총 20개의 회귀분석을 통해 얻어진 독립변수와 종속변수 사이의 상관관계를 2차 회귀방정식과 이에 대한 결정계수(R2)를 표현하여 Table 3에 나타내었으며, 위 조건에 따라 구한 곤충단백 가수분해물의 Alcalase (X1)–Flavourzyme (X2)–시간(Y)의 3차원 도식화 모형은 Fig. 1에 나타내었다.
| Protein hydrolysates | Predicted values | Experimental values | |
|---|---|---|---|
| Degree of hydrolysis (Y, µg/mL) | Tenebrio molitor | 653.23 | 677.51±5.47 |
| Gryllus bimaculatus | 632.46 | 656.78±3.43 |
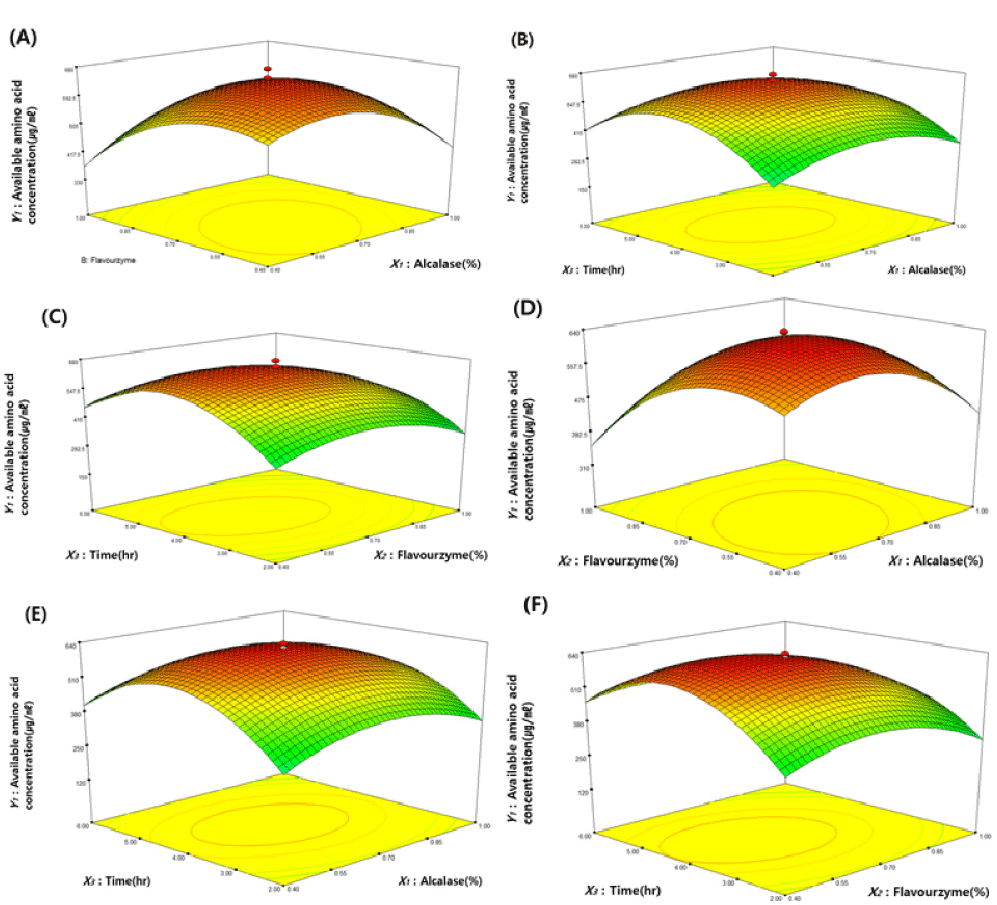
이를 통하여 갈색거저리 가수분해물의 최적 조건은 Alcalase (0.65%), Flavourzyme (0.61%), 4.14시간으로 나타났으며, 쌍별귀뚜라미 가수분해물의 최적 조건은 Alcalase (0.64%), Flavourzyme (0.59%), 3.85 시간으로 나타났다. 결정계수(R2)는 독립 변수에 대하여 1에 가까운 값을 나타냈으며, 이는 독립변수와 종속변수 사이의 관계가 신뢰할 만한 수준임을 알 수 있었다.
최적 조건에 따라 제조한 곤충단백 가수분해물의 DPPH 라디칼 소거 활성은 Table 4에 제시하였다. 갈색거저리 가수분해물의 RC50 값은 0.28±0.017 mg/mL로, 이는 기준물질인 Trolox의 0.07±0.011 mg/mL 대비 약 25% 수준의 항산화 활성을 나타내었다. 본 결과는 곤충 단백질을 이용한 선행 연구들과 유사하며(Yu et al., 2017; Kim et al., 2018; Ma et al., 2023), 갈색거저리 가수분해물이 라디칼 제거에 효과적인 항산화 활성을 지님을 시사한다. 이러한 항산화 활성은 가수분해물 내에 함유된 아미노산과 펩타이드 조성에 기인할 것으로 판단되며(Kim et al., 2018; Ma et al., 2023; Quah et al., 2023), 이는 항산화 반응에 기여할 수 있는 생리활성 성분이 충분히 존재함을 의미한다.
| RC50 (mg/mL) | TEAC1) (mg TE/g) | ||
|---|---|---|---|
| Protein hydrolysates | Tenebrio molitor | 0.28±0.017 | 305.2±0.010 |
| Gryllus bimaculatus | 5.77±0.13 | 6,289.3±20.61 | |
| Trolox | 0.07±0.011 | - |
한편, 쌍별귀뚜라미 가수분해물의 RC50 값은 5.77±0.13 mg/mL로, 갈색거저리 가수분해물에 비해 약 21배 높은 값을 나타내었다. 이는 쌍별귀뚜라미 가수분해물이 갈색거저리 가수분해물보다 우수한 DPPH 라디칼 소거 활성을 나타냄을 의미한다. 선행 연구에서도 쌍별귀뚜라미 가수분해물은 다양한 효소 처리 및 추출 조건에서 높은 항산화 활성을 보이는 것으로 보고되었으며, 특히 Alcalase 등 효소 가수분해를 통해 얻은 저분자 펩타이드가 DPPH 라디칼 소거 활성 및 FRAP 등 항산화 지표에서 우수한 결과를 나타낸 바 있다(Fashakin et al., 2023). 또한, 쌍별귀뚜라미 가수분해물의 항산화 활성은 풍부한 아미노산 조성 및 효소적 가수분해에 의해 생성된 생리 활성 펩타이드에 기인하는 것으로 보고되고 있다(Chotphruethipong et al., 2024).
최적 조건으로 제조한 갈색거저리 및 쌍별귀뚜라미 가수분해물의 ABTS 라디칼 소거 활성 측정 결과는 Table 5에 제시하였다. 갈색거저리 가수분해물의 RC50은 0.25±0.017 mg/mL로 나타났으며, 이는 기준물질인 Trolox의 RC50인 0.05±0.007 mg/mL 대비 약 20% 수준의 항산화 활성을 보이는 것으로 확인되었다. 본 결과는 갈색거저리 가수분해물의 라디칼 소거능을 보고한 선행 연구(Yu et al., 2017)와 유사한 경향을 보이며, 가수분해물 내 함유된 아미노산 및 펩타이드의 항산화 기여 가능성을 시사한다.
| RC50 (mg/mL) | TEAC1) (mg TE/g) | ||
|---|---|---|---|
| Protein hydrolysates | Tenebrio molitor | 0.25±0.017 | 278.4±0.013 |
| Gryllus bimaculatus | 5.77±0.13 | 6,425.5±30.00 | |
| Trolox | 0.05±0.007 | - |
한편, 쌍별귀뚜라미 가수분해물의 RC50은 5.77±0.13 mg/mL로, 갈색거저리 가수분해물에 비해 약 20배 높은 항산화 활성을 나타내었다. Alcalase를 이용하여 쌍별귀뚜라미 단백질을 가수분해한 선행 연구(Fashakin et al., 2023)에서도 ABTS 라디칼 소거활성이 우수하게 보고된 바 있으며, 이는 본 연구 결과와 유사한 경향을 보인다. 이러한 결과는 쌍별귀뚜라미 가수분해물이 항산화 기능성 식품 소재로 활용될 수 있는 잠재력을 지니고 있음을 시사한다.
최적 조건으로 제조한 갈색거저리 및 쌍별귀뚜라미 가수분해물의 FRAP (철환원능) 분석 결과는 Table 6에 제시하였다. 갈색거저리 가수분해물의 RC50은 0.04±0.003 mg/mL로 나타났으며, 기준물질인 Trolox의 RC50인 0.01±0.002 mg/mL에 대비하여 약 25% 수준의 환원력을 보이는 것으로 확인되었다. 본 결과는 앞서 수행한 DPPH 실험 결과와 유사한 경향을 나타내며, 재현성이 높은 FRAP 분석의 특성으로 미루어 보아 갈색거저리 내 아미노산 및 펩타이드 성분이 일정 수준의 환원력을 나타내는 것으로 판단된다. 또한 ABTS 분석 결과와의 차이는 각 분석법의 라디칼 제거 작용기전 차이에 기인하는 것으로 사료된다(Badarinath et al., 2010).
| RC50 (mg/mL) | TEAC1) (mg TE/g) | ||
|---|---|---|---|
| Protein hydrolysates | Tenebrio molitor | 0.04±0.003 | 3,902.1±11.57 |
| Gryllus bimaculatus | 0.46±0.003 | 44,873.2±211.01 | |
| Trolox | 0.01±0.002 | - |
한편, 쌍별귀뚜라미 가수분해물의 RC50은 0.46±0.003 mg/mL로, 갈색거저리 가수분해물 대비 약 11배 이상의 환원력을 나타내었다. 이는 쌍별귀뚜라미 가수분해물에 존재하는 히드록시기(–OH)에 의한 전자 공여능이 우수하여 활성산소의 연쇄 반응을 보다 효과적으로 억제하였기 때문으로 사료된다(Kim et al., 2018). 이러한 결과는 쌍별귀뚜라미 가수분해물이 항산화 기능성 소재로 활용될 수 있는 가능성을 보여준다.
최적 조건으로 제조한 갈색거저리 가수분해물의 총 폴리페놀 함량 결과는 Table 7에 제시하였다. 갈색거저리 가수분해물의 총 폴리페놀 함량은 기준물질인 갈산(Gallic acid)의 당량으로 환산하였을 때 18.42±2.82 mg GAE/mL로 나타났다. 본 결과는 곤충 단백을 이용한 선행 연구(Kim et al., 2020)와 유사한 수준이며, 해당 연구에서 제시된 더덕이나 당근 등 식물성 식품의 폴리페놀 함량보다 높은 수치를 보여, 갈색거저리 가수분해물이 식물성 소재에 못지 않은 항산화 능력을 지니고 있음을 확인할 수 있었다(Jung et al., 2019).
| TPC (mg GAE1)/mL) | Linear regression (R2) | ||
|---|---|---|---|
| Protein hydrolysates | Tenebrio molitor | 18.42±2.82 | y=0.0011x+0.0453 (0.9843)*** |
| Gryllus bimaculatus | 177.71±1.12 |
쌍별귀뚜라미 가수분해물의 총 폴리페놀 함량은 177.71±1.12 mg GAE/mL로 나타났으며, 이는 갈색거저리 가수분해물 대비 현저히 높은 수치이다. 한편, 쌍별귀뚜라미 분말의 총 폴리페놀 함량을 측정한 선행 연구에서는 6.61 mg GAE/g으로 보고된 바 있으며(Kim et al., 2020), 본 연구 결과는 가수분해 과정을 통해 쌍별귀뚜라미의 폴리페놀 함량이 크게 증가할 수 있음을 시사한다.
최적 조건에 따라 제조한 갈색거저리 가수분해물의 과산화수소(H2O2) 소거 활성 측정 결과는 Table 8에 제시하였다. 갈색거저리 가수분해물의 RC50은 58.34±0.11 mg/mL로 나타났으며, 이는 원정박이꽃무지 유충 단백질 가수분해물을 이용한 선행 연구 결과(Lee et al., 2017)와 유사한 수준으로, 갈색거저리 가수분해물 역시 우수한 과산화수소 소거 활성을 지니고 있음을 확인할 수 있었다.
| RC50 (mg/mL) | Linear regression (R2) | ||
|---|---|---|---|
| Protein hydrolysates | Tenebrio molitor | 58.34±0.11 | y=0.7296x+7.4351 (0.9909)*** |
| Gryllus bimaculatus | 5.11±0.008 |
쌍별귀뚜라미 가수분해물의 RC50은 5.11±0.008 mg/mL로 나타나, 갈색거저리 가수분해물이 더 높은 과산화수소 소거 활성을 나타내어 기존의 다른 결과와 차이를 보였다. 다만, 쌍별귀뚜라미 가수분해물은 DPPH, ABTS 등 다른 항산화 활성 분석 결과에 비해 상대적으로 낮은 소거 활성이 나타났는데, 이는 폴리페놀이나 플라보노이드 외의 환원력이 큰 성분의 존재 여부에 기인한 것으로 사료된다(Arise et al., 2016). 이와 같은 결과는 쌍별귀뚜라미 유래 항산화 성분의 조성 특성이 분석법에 따라 상이하게 작용할 수 있음을 시사한다. 항산화 활성은 분석법의 작용 기전, 반응 조건, 그리고 항산화 물질의 구조적 특성 등에 따라 상이한 결과를 나타낼 수 있으며, 이는 각각의 분석법이 항산화 작용을 평가하는 방식이 서로 다르기 때문이다. 일반적으로 DPPH 및 ABTS는 자유라디칼 소거 능력에 기반하고, FRAP은 금속 이온 환원력을, 과산화수소 소거 분석은 비 라디칼 형태의 활성산소종 제거 능력을 측정하는 등 각각의 원리와 민감도가 상이하다(Badarinath et al., 2010). 따라서 동일한 시료라 하더라도 분석법에 따라 항산화 활성의 절대값과 해석 결과에 차이가 발생할 수 있으며, 이는 시료 내 존재하는 주요 항산화 성분의 종류 및 작용 특성에 기인하는 것으로 판단된다.
갈색거저리 및 쌍별귀뚜라미 가수분해물의 용해도를 pH별로 측정한 결과는 Fig. 2에 제시하였다. 두 가수분해물은 pH 1.5∼4의 산성 구간에서는 20∼30% 가량의 낮은 용해도를 나타내었으나, pH 5부터 용해도가 급격히 증가하여 pH 8에서 모두 약 119% 가량으로 가장 높은 용해도를 나타냈다.
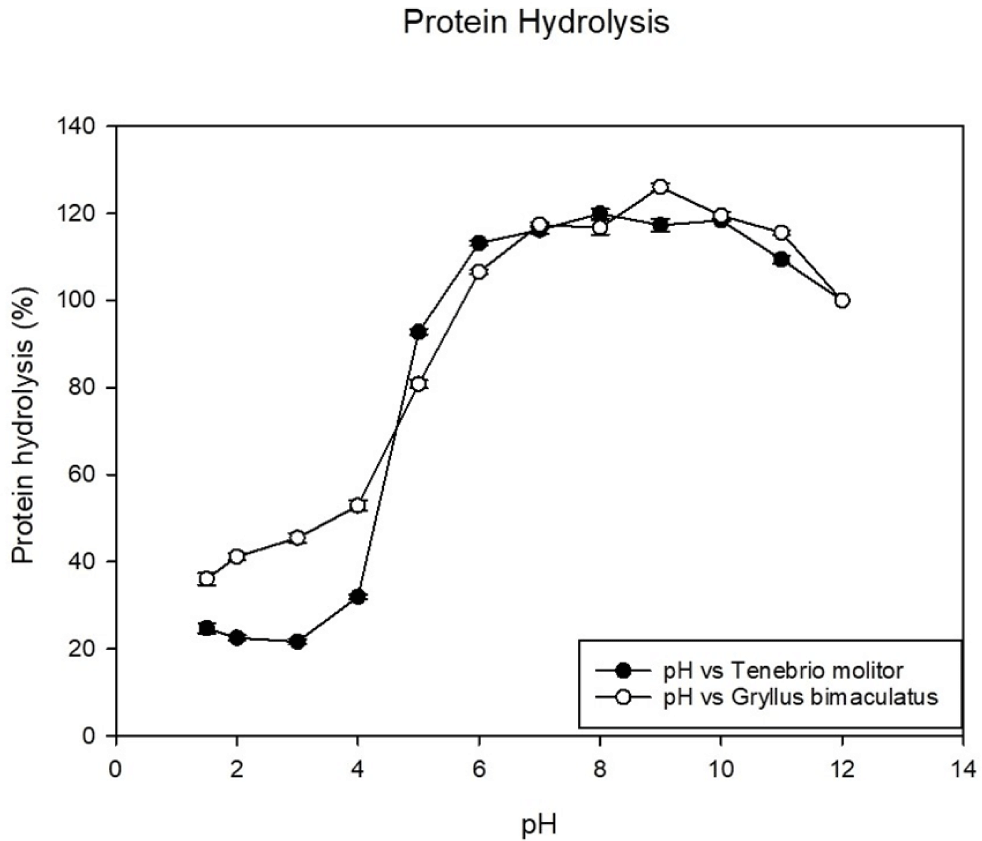
이러한 경향은 효소에 의해 단백질이 가수분해되며 분자가 단편화(fragmentation)되어 pH 5 이상의 구간에서도 용해도가 높게 유지되는 결과로 해석된다(Leni et al., 2020). 본 연구 결과를 통해 두 가수분해물은 일반적인 식품의 pH 범위인 5∼9 내에서 우수한 용해 특성을 나타내며, 다양한 식품에 첨가물로 활용될 수 있는 소재적 물성을 지닌 것으로 판단된다.
갈색거저리 및 쌍별귀뚜라미 가수분해물의 유분흡착력 측정 결과는 Table 9에 제시하였다. 갈색거저리 가수분해물의 유분흡착력은 4.41±0.67 g/g sample로 나타났으며, 이는 기존의 갈색거저리를 대상으로 한 선행 연구(Son & Hwang, 2022)에서 보고된 유분흡착력 범위(1.03∼2.05)보다 높은 수치로, 특히 화학적 용매를 이용하여 추출한 시료에서 2.05의 최대값을 보인 바 있다. 동일한 탈지 과정을 거쳤음에도 유분흡착력의 차이가 발생한 이유는 단백질 가수분해를 통해 펩타이드 및 저분자 단백질로 전환됨에 따라 소수성 아미노산(류신, 발린, 페닐알라닌 등)의 잔기가 표면에 노출되어 유지와의 상호 작용이 증가함으로써 얻어진 결과로 사료된다(Leni et al., 2020). 일반적으로 지질 함량이 낮을수록 유분흡착력이 증가한다는 기존 보고와 일치하는 경향을 나타내며, 본 연구에 사용된 갈색거저리 가수분해물은 지질이 비교적 낮고 유분흡착력이 우수한 것으로 판단된다.
| OACa) (g/g sample) | EAIb) | ||
|---|---|---|---|
| Protein hydrolysates | Tenebrio molitor | 4.41±0.67 | 0.97±0.05 |
| Gryllus bimaculatus | 2.68±0.31 | 0.97±0.01 |
반면, 쌍별귀뚜라미 가수분해물의 유분흡착력은 2.68±0.31 g/g sample로 갈색거저리 가수분해물보다 낮은 수치를 보였다. 이는 쌍별귀뚜라미 가수분해물이 상대적으로 더 높은 지질 함량을 포함하고 있을 가능성을 시사하며, 유분흡착력 측면에서는 갈색거저리 가수분해물이 보다 유리한 특성을 지니고 있음을 나타낸다.
또한, 두 가수분해물의 유화력 측정 결과 갈색거저리(0.97±0.05)와 쌍별귀뚜라미(0.95±0.01) 모두 0.95 이상으로 비교적 높은 유화 활성을 나타내었다. 기존 연구에 따르면 갈색거저리 가수분해물의 유화력은 0.36∼0.63 수준으로, 화학적 용매를 활용한 추출 조건에서 최대 0.63으로 보고된 바 있다. 유화력은 시료 내 단백질 함량이 높을수록 계면활성제와 유사한 작용을 하여 증가하는 특성이 있으며, 본 연구의 결과는 갈색거저리 및 쌍별귀뚜라미 가수분해물 모두가 높은 단백질 함량을 가지고 있음을 간접적으로 보여준다. 따라서 본 연구에서 사용한 가수분해물은 유분흡착력 및 유화력 측면에서 모두 양호한 물성을 나타내었다.
갈색거저리 및 쌍별귀뚜라미 가수분해물의 단백질 소화율(in vitro)을 측정한 결과는 Table 10에 제시하였다. 갈색거저리 가수분해물의 단백질 소화율은 71.56±8.90%로 나타났으며, 이는 선행 연구에서 액상발효추출을 통해 얻은 단백질 소화율(91.02∼95.86%)보다는 낮은 수치이나, Ramos (1997)에 의해 보고된 21종의 식용곤충 단백질 소화율 범위(60∼98%)와 비교했을 때, 중간 정도의 수준에 해당하는 것으로 판단된다.
| Protein digestibility (%) | ||
|---|---|---|
| Protein hydrolysates | Tenebrio molitor | 71.56±8.90 |
| Gryllus bimaculatus | 44.88±10.39 |
반면, 쌍별귀뚜라미 가수분해물의 소화율은 44.88±10.39%로, 갈색거저리 가수분해물에 비해 낮은 값을 나타내었다. 이러한 차이는 여러 요인이 복합적으로 작용한 것에서 기인한다. 곤충의 경우 귀뚜라미에 있어 보통 1.6∼10.7 g/100 g (약 1.6%∼10.7% 범위) 존재하고(Ochiai et al., 2024), 키틴-단백질 결합체 형태로 존재하는 경우가 많아(Zhao et al., 2019) 효소의 효율적인 작용이 제한될 수 있고, 불용성 섬유질이 분해되지 않음에 따라 전체 소화율이 크게 개선되지 않을 수 있는 등(Kim et al., 2023)의 영향을 받은 것으로 사료된다.
따라서 본 연구 결과는 쌍별귀뚜라미 가수분해물보다 갈색거저리 가수분해물이 소화 효율 측면에서 더 우수한 특성을 지니며, 식품 소재로 적용 시 영양학적 측면에서 보다 유리하게 작용할 수 있음을 시사한다.
최적 조건에 따라 제조된 갈색거저리 및 쌍별귀뚜라미 가수분해물의 주요 아미노산 조성을 확인하기 위해 분석을 수행하였으며, 그 결과는 Table 11에 제시하였다.
갈색거저리 가수분해물의 구성 아미노산 분석 결과, 글루탐산이 8,850.00 mg/100 g으로 가장 높은 함량을 나타내었으며, 그 다음으로 프롤린(6,443.67 mg/100 g), 아스파르트산(6,232.90 mg/100 g) 순으로 높게 나타났다. 유리 아미노산의 경우 알라닌이 13,250.38 mg/100 g으로 가장 높은 함량을 보였으며, 이어서 프롤린(3,362.68 mg/100 g), 류신(2,430.45 mg/100 g), 아르기닌(2,324.05 mg/100 g) 순으로 확인되었다. 쌍별귀뚜라미 가수분해물에서는 총 17종의 구성 아미노산이 검출되었으며, 글루탐산이 8,139.33 mg/100 g으로 가장 높은 함량을 나타내었고, 아스파르트산(5,858.92 mg/100 g), 알라닌(5,503 mg/100 g) 순으로 높게 나타났다. 이외의 아미노산은 448.62∼4,861.30 mg/100 g 범위의 함량을 보였다. 유리 아미노산의 경우 총 20종이 검출되었으며, 알라닌이 14,947.92 mg/100 g으로 가장 높은 함량을 나타냈다. 그 다음으로 아르기닌(2,666.40 mg/100 g), 류신(1,806.16 mg/100 g) 순으로 확인되었으며, 기타 유리 아미노산은 1,247.61∼1,997.40 mg/100 g 범위로 검출되었다.
구성아미노산에서 가장 높게 나타난 글루탐산의 경우, 단백질 내에 존재하는 글루타민으로부터 생성되며 조미료로 사용되는 글루탐산나트륨의 기본 성분이자, 폴리감마글루탐산의 형태로 존재할 때 항염증 효능을 가지고 있다고 알려져 있다. 추가적으로, 유리아미노산에서 가장 높게 나타나는 알라닌의 경우에도 항염증 효능을 직/간접적으로 가지고 있음을 알 수 있다. 알라닌을 단독 투여할 때는 물론이고(Choi et al., 2017), 글루탐산을 알라닌과 동시 투여 시 강제 운동에 의한 근육의 염증 반응을 완화시킨다는 선행 연구 결과(Raizel et al., 2016)가 존재한다. 알라닌의 경우 프롤린과 함께 탄수화물에서 글리코겐을 만드는 기능을 높여 운동 전이나 운동 중에 운동 능력을 유지할 수 있다는 선행 연구 결과가 있으며(Baquet et al., 1991), 식품에 사용될 때에는 강화제, 영양제, 식이보충제, 향미증진제 등으로 사용되므로 본 연구에서 사용된 곤충단백 가수분해물이 면역 강화를 위한 소재 및 조미료 소재의 기본 원료로써 사용될 수 있을 것으로 생각된다. 가수분해된 곤충 단백질 속 소수성 아미노산(발린, 이소류신, 프롤린) 및 양전하 아미노산(아르기닌, 리신 등)이 항염, 항산화, 항고혈압에 영향을 미치므로(Rivera-Jiménez et al., 2022), 아미노산에 따른 곤충단백의 기능성에 대해서도 고려할 필요가 있을 것으로 생각된다. 아울러, 갈색거저리 가수분해물과 쌍별귀뚜라미 가수분해물 모두 <3 kDa 이하의 저분자 펩타이드에서 항산화 활성이 가장 뛰어나나, 갈색거저리는 특히 <1.5 kDa 이하에서 반응성 기여가 큰 트립토판, 티로신 등이 C-말단에서 항산화능을 강화하며, 펩타이드 분포(분자량)에 따라 다른 항산화 활성 차이를 가지고 있는 것으로 생각된다. 쌍별귀뚜라미의 경우 359∼721 Da 사이의 분자량에서 ABTS 항산화능 및 금속 킬레이트 활성이 높은 것으로 나타난 선행 연구의 결과(Fashakin et al., 2023)로 미루어 보아, 항산화 활성에 영향을 미치는 펩타이드 분포 역시 고려되어야 할 부분으로 사료된다.
요 약
본 연구는 미래의 식품 자원으로 주목받고 있는 갈색거저리 및 쌍별귀뚜라미에서 유래한 단백질 가수분해물의 생산 조건을 최적화하고 기능적 특성을 규명하고자 했다. 반응표면분석법(RSM)을 적용하여 효소 가수분해 조건을 최적화하고, 중심합성계획모델을 적용하여 최적의 조건을 도출하였다. 이러한 조건에서 생성된 곤충 단백 가수분해물은 항산화 활성(DPPH, ABTS, FRAP 분석 등)과 용해도, 유지흡착력, 유화력, 시험관 내 소화율 등 물리화학적 특성을 평가하였다. 갈색거저리 가수분해물의 경우 우수한 소화율과 유지흡착력을 보였고, 쌍별귀뚜라미 가수분해물의 경우 높은 항산화 활성을 보였다. 두 가수분해물 모두 넓은 pH 범위에서 높은 용해도를 보였기에 다양한 식품 소재로 사용될 수 있는 가능성이 높을 것으로 사료된다. 본 연구는 곤충 유래 단백질 가수분해물을 기능성 식품 재료로 활용할 수 있는 가능성을 강조하며, 전 세계의 식량 불안정을 해결하기 위한 대체 단백질 공급원 개발에 대한 방법을 제공한다. 최적화된 단백질 가수분해물은 기능성 식품의 유망한 성분으로 작용 가능하므로, 지속 가능한 식품 및 미래의 영양에 대한 올바른 전략을 구성하는 데 기여할 수 있다.







