서 론
전 세계적으로 매년 약 13억 톤의 음식물 쓰레기가 발생하는 것으로 추정되며(FAO, 2013), 생산된 식품 중 사용되지 않는 부위 등의 부산물로 인한 손실된 경제적 가치는 약 1조 달러에 달하는 것으로 보고되었다(FAO, 2019). 식품 부산물의 수거 및 처리에는 상당한 비용이 소모되며, 처리 과정에서 발생하는 유해 화학물질 및 지구온난화 등의 문제로 인해 장기적으로 경제적 및 환경적 부담을 감소할 수 있는 해결 방안이 요구되고 있다(Kim et al., 2023a). 부산물의 활용은 새로운 부가가치를 창출하여 자원 이용의 효율성을 증대시킬 수 있는 방안으로 주목받고 있다. 특히, 다양한 식품 부산물에 기능성분이 다량 잔존해 있어 기능성 소재 자원으로 활용하고자 하는 선행연구가 보고된 바 있으며(Ayala-Zavala et al., 2011), 이에 따라 부산물을 기능성 소재의 잠재적 공급원으로 활용할 수 있을 것으로 판단된다.
생강은 국내의 경북, 충남 및 전북 지역에서 생산되고 있으며, 2023년 기준 생산량은 22,848톤으로 보고되었다(Statistics Korea, 2023). 생강은 국내외적으로 염지 또는 당저장, 다대기 및 건조분말화 제품, 올레오레진, 오일, 생강음료 등 다양한 가공 형태로 이용되고 있다. 생강 가공 중에 상당량이 부산물로 발생하고 있으며 그 중 대표적인 것이 생강 착즙박(by-product of ginger juice, ginger pomace)으로 착즙과정 중 생성되고 있으며 원료, 선별, 세척, 파쇄, 착즙, 여과, 포장 단계를 거치는 동안 30–40%의 착즙박이 발생되고 있다. 대부분은 폐기되고 있으며 부산물 처리의 어려움 및 폐기비용 증가 등으로 인한 부담이 늘어나고 있어 생강박을 활용할 수 있는 기술개발 요구 및 그 필요성은 증대되고 있는 실정이다.
생강부산물에는 진저롤, 식이섬유, 생강 에센셜오일 등 다양한 기능성분이 함유되어 있으며(Bao et al., 2021), 항산화(Tinello & Lante, 2019), 항염증(Li et al., 2022) 등의 효과가 보고되었다. 또한 생강부산물에서 유래한 기능성분을 활용하여 필름 및 포장재, 항균 소재, 환경 정화제 등의 적용 가능성을 평가한 연구가 수행된 바 있다(Inthalaeng et al., 2023).
기능성 및 친환경 소재로서의 잠재성을 가진 생강 착즙박은 전분, 섬유소, 단백질 등으로 구성되어 있으며(Konar et al., 2013), 전분 함량이 높아 단순 가공 처리만으로는 수율이 낮아 산업적 활용에 한계가 있다. 이러한 문제를 개선하기 위해 생강 착즙박을 효과적으로 처리하여 수율을 향상시키고 기능성분 함량을 극대화하는 연구가 필요하다. 효소 처리 수용화 기술은 식품 가공에 널리 이용되고 있으며 전분, 섬유소, 펙틴 등의 다당류 분해를 촉진하여 유용물질의 추출 효율을 높이는 것으로 알려져 있다(Nam et al., 2018).
따라서 본 연구에서는 생강 착즙박에 다양한 방법으로 효소 처리 기술을 적용한 후 제조한 추출물의 수용화 및 기능성분을 비교 분석하고 효소 처리 최적 조건을 선정하여 추출 수율과 기능성분을 증진하고자 하였다. 또한, 대용량 생산 적용성을 평가하여 농가 및 식품 가공업체에서의 실용 가능성을 검토하고, 다양한 가공 소재로의 활용 가능성을 제시하여 산업적 적용을 위한 기초 자료를 제공하고자 하였다.
재료 및 방법
본 실험에서는 전북 부안군 농장 760 농가에서 2024년에 구입한 생강 착즙박을 냉동고(–20℃)에 보관하면서 사용하였다. 효소는 세포벽 분해효소인 Pectinase (P; Pectinex Ultra SP-L)와 전분 분해효소 α-amylase (T; Termamyl 2X)를 Novozymes (Novo Nordisk, Copenhagen, Denmark)사에서 구입하였다. Folin-Ciocalteu’s reagent, gallic acid, catechin, acetic acid (Sigma-Aldrich Co., St. Louis, MO, USA)을 구입하였다. 표준품은 6-gingerol (6-G), 8-gingerol (8-G), 10- gingerol (10-G), 6-shogaol (6-S), 8-shogaol (8-S), 10-shogaol (10-S)은 ChromaDex (Chromadex, Irvine, CA, USA)사에서 구입하였다. 그 밖의 시약은 analytical 및 HPLC 등급을 사용하였다.
생강 착즙박의 일반성분은 AOAC (2005)에 준하여 분석하였다. 수분은 105℃ 상압가열 건조법, 조단백질은 Kjeldahl 분해법, 조지방은 Soxhlet 추출법, 조회분은 550℃ 직접회화법으로 측정하였다. 탄수화물은 시료 전체를 100%로 하고, 수분, 단백질, 조지방, 조회분 함량(%)을 뺀 값으로 나타냈다. 식이섬유는 효소-중량법(Prosky et al., 1988), 무기질 및 비타민은 AOAC (2005) 방법에 따라 분석을 진행하였으며 비타민 A, C, E, B1, B2, B3, B6, B12, β-카로틴은 HPLC (high performance liquid chromatography, Agilent 1100 series, Agilent Technologies, Palo Alto, CA, USA), 비타민 D는 LC-MS/MS (Triple Quad 4500, AB Sciex, Framingham, MA, USA)를 이용하여 분석하였다.
생강 착즙박의 미생물, 곰팡이독소, 잔류농약, 중금속은 식품공전(MFDS, 2024a) 및 AOAC (2005) 규정에 따라 분석하였다. 미생물 수 측정은 생강 착즙박을 멸균백에 넣고 멸균생리식염수를 가하여 1분간 교반한 후, 상등액을 취해 단계적으로 희석한 후 1 mL씩 취하여 일반세균수, 대장균군, 대장균, 진균수, 장출혈성대장균수 측정용 배지(Petrifilm, 3M, Co., St, Poul, MN, USA)에 접종하였다. 배양 후 colony 수를 측정하여 log colony forming unit [CFU/g (or mL)]로 나타냈다(MFDS, 2024b). 곰팡이독소는 총아플라톡신(B1, B2, G1, G2의 합), 아플라톡신 B1, B2, G1, G2, 오크라톡신 A를 HPLC-MS/MS를 사용하여 분석하였다(MFDS, 2024d). 잔류농약은 GC, LC, GC-MS/MS, LC-MS/MS를 활용하여 Table 1과 같이 113종을 분석하였다(MFDS, 2024c). 중금속 분석은 Pb, Cd, As는 ICP-MS (inductively coupled plasma, Perkin Elmer, Waltham, MA, USA), Hg은 자동수은분석기를 이용하여 측정하였다(MFDS, 2024d).
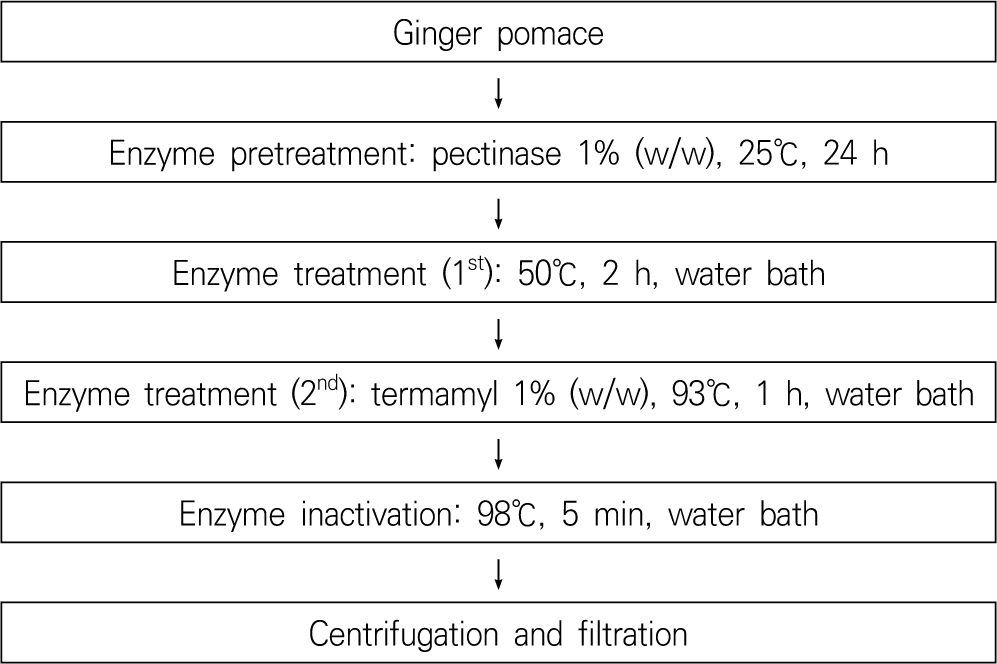
생강 착즙박 효소 처리 추출은 Nam et al. (2018)의 선행 연구를 기반으로 효소 처리 기술을 활용하였으며 효소 전처리 조건은 Kim et al. (2024a)의 최적 조건을 변형하여 적용하였다. 효소 처리 방법 및 추출 조건은 Fig. 1과 Table 2에 나타냈다. 열수추출물인 대조구 (CON)은 생강 착즙박 0.1 kg에 10배에 해당하는 증류수를 가한 후 100℃, 2시간 처리하여 추출물을 제조하였다. 효소 처리구 GP1은 세포벽 분해효소인 P를 기질대비 1% (w/w) 농도로 첨가하여 50℃에서 2시간 동안 1차 추출을 진행한 다음, 전분 분해효소인 T를 P와 동일량 첨가하여 93℃에서 1시간 추출하였다. 효소 불활성화는 98℃, 5분 진행하였다. GP1의 대조구 CON-GP1은 GP1과 동일한 방법으로 효소 첨가 없이 진행하였다. GP2는 생강 착즙박 0.1 kg에 P 1%를 첨가·혼합하여 습도 95%, 온도 50℃(auto temp & humid chamber, Hanyoung Nux Co. Ltd., Incheon, Korea)에서 24시간 정치한 후 GP1과 동일한 방법으로 효소 추출하였다. 효소 전처리구 GP3는 GP2와 동일한 방법으로 전처리 온도를 25℃로 조정하여 진행하였다. 모든 추출액은 6,683 g(relative centrifugal force, RCF)에서 15분 동안 원심분리(2236R, GYROZEN Co., Ltd., Gimpo, Korea)한 후 여과지(Whatman No. 4, GE Healthcare Co., Bukinghamshire, UK)를 이용하여 감압여과 하였다. 이 상등액은 수용화 특성 및 기능성분 분석 시료로 사용하였다.
| Samples | Enzyme pretreatment (P1)) | Enzymatic extract | Conventional extract | ||||
|---|---|---|---|---|---|---|---|
| 1st enzyme | 2nd enzyme | ||||||
| 50℃ | 25℃ | P | 50℃, 2 h | T | 93℃, 1 h | 100℃, 2 h | |
| CON | O | ||||||
| CON-GP1 | O | O | |||||
| GP1 | O | O | O | O | |||
| GP2 | O | O | O | O | |||
| GP3 | O | O | O | O | |||
생강 착즙박 효소 전처리 조건 선정은 상기의 효소 처리 실험에서 최적으로 선정된 GP3를 이용하여 효소 첨가 및 효소 전처리 조건에 따른 결과 차이를 확인하고자 하였다. 효소 전처리 시 가수, 효소 첨가, 추출 온도 등의 세부적인 처리 조건은 Table 3과 같다. GP3-1은 GP3의 효소 전처리 방법으로 진행한 후 열수추출하였다(100℃, 2시간). GP3-2는 GP3의 방법에서 효소 첨가를 제외한 처리 방법으로 진행하였고, GP3-3는 GP3-1과 동일한 조건에서 GP3, GP3-1, GP3-2, GP3-3은 효소 전처리의 가수처리 없이 진행하였으며, GP3-4, GP3-5, GP3-6, GP3-7은 10배 물을 첨가하여 처리하였다.
| Samples | Enzyme pretreatment (24 h) | Extract methods | ||
|---|---|---|---|---|
| Water×10 | P1) | 1st 50℃, 2 h → 2nd 93℃, 1 h | 100℃, 2 h | |
| GP3 | O | O | ||
| GP3-1 | O | O | ||
| GP3-2 | O | |||
| GP3-3 | O | |||
| GP3-4 | O | O | O | |
| GP3-5 | O | O | O | |
| GP3-6 | O | O | ||
| GP3-7 | O | O | ||
생강 착즙박 효소 전처리 시간은 추출물의 수용화 특성 및 기능성분 함량 차이를 비교하여 최적 시간을 선정하였다. GP3를 이용하여 2, 4, 10, 24시간 동안 처리하여 비교하였고 추출 과정은 GP3와 동일한 방법으로 진행하였다.
생강 착즙박 용량별 추출은 상기에서 최적의 조건으로 선정된 GP3 (효소 전처리, 25℃, 24시간)을 이용하여 진행하였다(Fig. 2). GP3는 냉동 생강 착즙박 15 kg을 해동(상온, 3일)한 후 플라스틱 채반으로 분말화하여 사용하였다. 시료에 P를 기질 대비 1% 첨가하여 혼합하였고 비닐포장하여 효소 전처리하였다. 생강 착즙박의 10배에 해당하는 물을 300 L 반응조에 넣어 예열하였고, 물의 내부 온도가 50℃에 도달하면 생강 착즙박 15 kg를 투입하였다. 1차 추출은 P의 최적온도인 50℃에서 2시간 처리하였고, 2차 추출은 T의 최적온도인 93℃에서 처리하였다. 물의 내부 온도가 93℃에 도달하면 전분 분해효소인 T를 P와 동일량 첨가하였다. 추출물의 효소 불활성화를 위해 98℃에서 5분간 가열하였다. GP1은 효소 전처리 과정 없이 최적온도에 도달 시 각각의 효소를 첨가하여 진행하였다. CON은 효소를 첨가하지 않고 앞과 동일량으로 100℃에서 2시간 동안 열수추출하였다. 모든 추출물은 이중면포(폴리프로필렌 부직포 재질, 60×70 cm, 2장)에 담아 압착 여과한 후 여과액은 6,683 g(RCF), 15분간 원심분리(2236R, GYROZEN Co., Ltd.)하였고 상등액은 여과지(Whatman No. 4, GE Healthcare Co.)로 감압여과 하였다. 생강 착즙박 소용량 추출은 시료량을 0.1 kg으로 조정하여 진행하였다. 시료량 대비 10배에 해당하는 물을 첨가하여 항온수조(Maxturdy-18, Daihan Scientific, Wonju, Korea)에서 추출하였다. 추출액은 위와 동일한 조건으로 여과하여 분석에 사용하였다.

수분용해지수(water solubility index, WSI)는 추출물을 여과한 상등액을 일정량 취하여 알루미늄 디쉬에 부은 후 그 무게를 측정한 후, 알루미늄 디쉬를 열풍건조기(ThermoStable OF-305, Daihan Scientific, Wonju-si, Korea)에 50℃에서 24시간 동안 건조한 뒤 그 상등액의 고형분 함량을 측정하였다. 산출식은 다음과 같다.
수분흡착지수(water absorption index, WAI)는 추출물의 상층액과 침전물을 분리하였고, 분리한 침전물을 건조하여 그 무게를 측정하였으며 다음과 같은 식으로 산출하였다.
총 폴리페놀(total polyphenols, TP) 함량은 Folin-Denis법(Gutfinger, 1981)을 일부 변형하여 비색 정량하였다. 추출물 시료 0.1 mL를 취하고 2% Na2CO3 수용액 2 mL를 가한 후 3분 동안 실온에서 정치하였다. 일정량의 50% Folin reagent 0.1 mL를 가하고 균일하게 혼합하여 실온에서 30분간 방치한 후 microplate reader (Infinite 200 PRO, Tecan Austria GmbH, Salzburg, Austria)를 사용하여 750 nm에서 흡광도 값을 측정하였다. 표준물질로 gallic acid를 사용하였으며 시료와 같은 방법으로 시험하고 얻은 검량선을 이용하여 환산한 후 정량하였다.
총 플라보노이드(total flavonoids, TF) 함량은 추출하여 얻은 상등액 0.25 mL에 증류수 1 mL와 5% NaNO2 수용액 0.075 mL를 넣고 혼합한 후 실온에서 5분 동안 방치하였다. 이후 10% AlCl6·6H2O 수용액 0.15 mL를 가하고 6분 동안 방치한 후 1 M NaOH 수용액 0.5 mL를 가하였다. 균등하게 혼합한 후 11분 동안 정치하였고, 반응액은 microplate reader (Infinite 200 Pro, Tecan, Austria GmbH)를 이용하여 510 nm에서 흡광도 값을 측정하였다. 표준물질은 (+)-catechin hydrate를 사용하여 검량선을 작성하였으며, TF 함량은 시료 g당 mg (+)-catechin으로 나타냈다.
지표성분 분석용 시료는 조건별로 처리한 생강 착즙박 효소처리 추출물을 0.2 µm nylon syringe filter로 여과한 후 UPLC 분석용 시료로 사용하였다. UPLC는 Waters ACQUITYTM Ultra Performance LC (Waters Corporation, Milford, MA, USA)를 이용하였고 분석조건은 Table 4와 같다. 표준물질은 6-G, 8-G, 10-G, 6-S, 8-S, 10-S의 검량선을 이용하여 산출하였다.
결과 및 고찰
생강 착즙박의 일반성분, 무기질, 비타민 함량을 분석한 결과는 Table 5와 같다. 일반성분은 탄수화물 22.48%, 조단백 1.19%였고, 수분은 72.76%, 식이섬유 10.62%로 나타났다. 국가표준식품성분표(Rural Development Administration, 2025)의 생강 수분함량이 88.2%로 보고되었으며 착즙박은 72% 정도였고 15% 정도가 착즙액으로 용출된 것으로 확인되었다. 무기질은 칼슘 60.91 mg/100 g, 나트륨 2.633 mg/100 g, 인 24.83 mg/100 g, 칼륨 527.0 mg/100 g, 마그네슘 22.85 mg/100 g, 철 1.240 mg/100 g, 아연 0.540 mg/100 g으로 나타났다. Lee et al. (2014)의 생강 부위별 이화학적 특성 및 항산화 활성 연구에서는 생강 뿌리의 무기질 함량 결과에서 칼륨 및 칼슘이 본 연구의 시료보다 각각 약 4.5, 3.6배 정도 높게 나타났다. 이는 생강의 지역적, 재배적 환경, 품종, 수확시기, 시료처리형태 등의 차이에 의한 것으로 사료된다. 비타민은 비타민 E(0.71 mg/100 g), 비타민 B2(0.07 mg/100 g), 비타민 B6(0.09 mg/100 g), 비타민 B12(0.29 µg/100 g) 및 베타카로틴(0.04 mg/100 g)이 검출되었다.
생강 착즙박의 미생물, 곰팡이 독소, 잔류농약, 중금속을 분석한 결과는 Table 6과 같다. 미생물은 일반세균수, 진균수가 각각 5.73, 4.64 log CFU/g (or mL)의 평균값을 확인하였다. 또한 대장균군은 1.46 log CFU/g (or mL)으로 나타났고, 대장균과 장출혈성대장균은 검출되지 않았다. Kim et al. (2010)은 다진 생강을 열처리하였을 때 대장균군은 대조군이 5.56 log CFU/g으로 나타났으나 50℃에서 30, 60분 처리군에서는 1.00 log CFU/g 이하였고, 55, 60℃ 처리조건에서는 검출되지 않았다고 보고하였다. 본 연구에서는 생 것 상태의 생강 착즙박을 분석하였기 때문에 소량의 미생물이 검출되었지만 가열 및 살균 등의 열처리를 동반한 추출 과정(50℃→93℃)을 통하여 미생물을 제어할 수 있을 것으로 판단된다. 곰팡이 독소는 불검출되었다. 잔류농약은 총 113종을 분석하였으며(Table 1), 검출된 성분은 metalaxyl, azoxystrobin, chlorantraniliprole 3종으로 각 0.044, 0.020, 0.020 mg/kg 함량을 나타냈다. 생강의 농약잔류허용기준치(MFDS, 2024e)는 각각 0.5, 0.05, 0.15 mg/kg으로, 생강 착즙박에서 검출된 3종 모두 기준한계치보다 검출량이 더 낮은 수치를 나타내 안전성에 영향은 없을 것으로 판단된다. 중금속은 납에서만 0.18 mg/kg의 함량이 미량으로 검출되었는데 우리나라 근채류에 대한 납의 기준한계치(MFDS, 2024a)는 0.1 mg/kg으로 생강 착즙박의 납 농도가 기준치보다 약간 높게 나타났다. 이는 생강 재배 시 농약, 비료 등을 사용한 토양에서의 영향으로 추측된다. 결과적으로 가열·살균 등의 열처리 공정을 통해 생강 착즙박의 미생물 안전성이 확보될 수 있을 것이라 사료된다.
효소 처리 조건에 따른 생강 착즙박 수용화 특성 측정 결과는 Table 7과 같다. WSI는 열수추출물인 대조구(CON), GP1의 대조구(CON-GP1)에 비해 효소 처리구(GP1), 50℃ 효소전처리 처리구(GP2), 25℃ 효소전처리 처리구(GP3)는 유의적으로 증가하였으며 CON 대비 GP3는 2배 이상 유의적으로 증가하였다. 효소 처리에 따른 단삼 추출물에 관한 연구에서는 대조구보다 효소(glucoamylase, cellulase, Rapidase C80 Max, ProteAX)를 첨가한 추출물에서 추출 수율이 약 1.1–1.4배 높아졌다고 보고되었으며, 생강 착즙박에 효소 처리했을 때 WSI가 증가하는 것은 본 연구결과를 뒷받침해주는 것이라 사료된다(Kim et al., 2015). 이러한 결과는 효소 전처리를 통해 고상 시료의 세포벽이 분해되고, 이후 가수분해가 촉진되어 추출 수율이 증가한 것으로 보인다. WAI는 12.60–14.82 범위였고, 시료 간에 유의적인 차이는 없었다.
| Samples | WSI1) | WAI |
|---|---|---|
| CON | 3.74±1.00b2) | 14.22±1.01 |
| CON-GP1 | 2.86±0.13b | 14.49±0.94 |
| GP1 | 8.02±0.47a | 14.82±1.26 |
| GP2 | 8.24±0.05a | 12.60±0.33 |
| GP3 | 7.52±0.28a | 13.70±0.24 |
| F-value | 74.602***3) | 3.055n.s. |
효소 처리 조건에 따른 생강 착즙박 기능성분 함량 측정 결과는 Table 8과 같다. TP 함량은 CON과 비교하여 효소 처리했을 때 1.6배까지 증가하였고, TF 함량은 CON 대비 1.4배까지 증가하는 것으로 나타났다. Yoo et al. (2013)은 당근을 효소 처리(protopectinase)했을 때 효소 처리하지 않은 당근에 비해 TP, TF가 각각 약 1.4, 1.7배 높아졌다고 하였으며 본 연구 결과와 일치하였다. 식물세포벽은 펙틴 기질에 싸여있는 골격 성분인 cellulose 및 hemicellulose로 구성되어 있다(Carpiat & Gibeau., 1993). 여기에 효소 전처리 과정을 통해 가수분해할 때 효소 작용이 증대되도록 작용하였으며 식물 세포벽에 결합되어 있는 불용성 폴리페놀 화합물이 효소분해를 통해 세포내 유용성분이 추출되어 항산화 함량값이 증대된 것으로 사료된다(Cinar, 2005). 이와 같은 결과 차이는 효소를 사용한 시료 처리 방법에 따라 다르게 나타날 수 있으며 세포벽 가수분해에 따른 유용성분 함량을 증대시킬 수 있는 방법이라고 판단된다.
1) TP, total polyphenol content; TF, total flavonoid content; GAE, gallic acid equivalent; CE, catechin equivalent; 6-G, 6-gingerol; 8-G, 8-gingerol; 10-G, 10-gingerol; 6-S, 6-shogaol; 8-S, 8-shogaol; 10-S, 10-shogaol; Total, sum of the 6, 8, 10 gingerol and 6, 8, 10 shogaol.
생강의 주요 매운맛 성분으로 알려진 gingerol 및 shogaol 중에서도 6-G은 인지질 등 산화를 억제하는 항산화력을 가진 것으로 보고되었다(Aeschbach et al., 1994). 6-G은 CON 대비 효소 처리구인 GP1은 약 1.2배, GP3가 약 1.7배 증가하였으며 GP3가 유의적으로 가장 높은 값을 나타냈다. 지표성분 총합을 나타내는 Total 함량 또한 6-G과 유사한 경향이었는데 CON이 가장 낮았고 CON과 비교했을 때 그 함량은 GP1은 1.2배, GP3가 약 1.7배 유의적으로 증가하였고 GP3가 가장 높았다. Kim et al. (2022)은 발효 및 효소 복합 처리에 의한 생강 추출물 연구에서 효소 처리(pectinase→α-amylase)만 진행한 효소 추출물의 Total 함량이 대조구에 비해 약 1.3배 증가되었고, 가장 높은 함량을 나타냈다고 보고하였으며 본 연구 결과를 뒷받침해주는 결과이다. 이러한 결과로, 생강 착즙박의 기능성분 추출 증진을 위해 선행 연구에서 보고된 효소 처리 기술을 적용했을 때 생강 착즙박의 수용화 특성 및 유용성분 추출 증진에도 효과가 있는 것을 확인할 수 있었다. 결과적으로, 유용성분 추출 증진에서는 기존의 효소 처리 기술을 변형(효소 전처리, 25℃, 24시간)하여 적용한 GP3가 가장 높게 나타나 최적의 방법으로 선정하였으며, 변형된 방법에 대한 최적 조건을 도출하고자 추가적인 실험을 진행하였다.
효소 전처리 조건에 따른 생강 착즙박 수용화 특성 측정 결과는 Table 9에 나타냈다. WSI는 2.63–7.52% 범위로, 효소만 첨가하여 전처리한 GP3, GP3-1이 높게 나타났는데 그 값은 각각 7.52, 6.91%였고, 효소와 물을 동시에 첨가하여 전처리한 GP3-4는 GP3 대비 약 1.3배 낮았다. WAI는 11.96–15.40 g/g의 범위로, GP3-4가 GP3보다 유의적으로 높게 나타났으며, WSI와 같은 경향을 나타냈다. 이러한 결과는 효소만을 이용한 전처리가 수용화 향상에 보다 효과적임을 의미한다.
효소 전처리 조건에 따른 생강 착즙박 기능성분 함량 측정 결과는 Table 10과 같다. TP 함량은 효소만 첨가하여 전처리한 GP3가 1.75 mg GAE/g으로 유의적으로 가장 높게 나타났으며 GP3-1 (0.28 mg GAE/g)에 비하여 1.5배 증가하였고, GP3-4에 비해 1.2배 증가하는 것으로 나타났다. TF 함량 또한 GP3 (0.42 mg CE/g)가 GP3-1 (0.28 mg CE/g)에 비하여 1.5배 증가하였다. 효소 처리와 열처리에 의한 인삼 추출물 연구에서는 인삼 분말을 가수분해효소(protease, α-amylase, cellulase, pectinase)로 처리하여 추출물을 제조한 결과, pectinase로 처리하였을때 추출 수율(76%) 및 총 페놀 함량(2.21%)이 가장 높게 나타났다(Kim et al., 2007). Jo et al. (2024)의 전처리 방법에 따른 생강과 생강박 분말 연구에서 시료를 열풍 건조하여 폴리페놀 함량 측정 결과 생강박이 생강보다 더 높았다고 하였는데 본 연구와 처리방법은 다르지만 생강을 가공 처리 후 남은 생강 착즙박 사용으로도 다량의 항산화 성분 획득 가능성은 충분할 것으로 판단된다. Jeong et al. (1999)은 생강 착즙 잔사에 termamyl로 90℃, 1시간 가수분해하였을 때 획득한 추출물의 수율은 분쇄 생강(100%) 대비 136%의 증가 현상을 보고하였는데, 본 연구에서 2차 추출 시 사용한 전분분해효소(T)의 영향으로 생강 착즙박 추출 수율 증가에 상승 작용한 것으로 생각된다.
1) TP, total polyphenol content; TF, total flavonoid content; GAE, gallic acid equivalent; CE, catechin equivalent; 6-G, 6-gingerol; 8-G, 8-gingerol; 10-G, 10-gingerol; 6-S, 6-shogaol; 8-S, 8-shogaol; 10-S, 10-shogaol; Total, sum of the 6, 8, 10 gingerol and 6, 8, 10 shogaol.
6-G 함량 범위는 23.44–83.61 mg/100 g으로 GP3가 유의적으로 가장 높았고, GP3-7이 가장 낮았다. 효소만 첨가하여 전처리한 GP3가 효소와 물을 동시에 첨가하여 전처리한 GP3-4에 비해 1.8배 더 높게 나타났다. Total 함량 범위는 24.24–86.28 mg/100 g으로 확인되었다. Total 함량은 6-G와 같은 경향성을 보였으며 GP3가 유의적으로 가장 높았고, GP3-7이 유의적으로 가장 낮았다. 또한 GP3의 Total 함량은 GP3-4 대비 1.8배 증가한 것으로 나타났다. 6-G 및 Total 함량 모두 가장 적은 함량을 나타낸 GP3-7 대비 GP3는 약 3.6배 더 많은 함량을 나타내는 것으로 확인되었다. 추출 온도에 따른 처리에서는 효소 처리 최적온도(50℃, 2시간→93℃, 1시간)으로 처리하는 방법이 열수추출 방법(100℃, 2시간)에 비하여 유용성분 추출에는 효과적인 것으로 나타났다. Nam et al. (2018)은 고압 효소 처리에 의한 생강의 다당류와 기능성분 수용화 연구에서 6-G이 대조구(0.45%) 대비 물 교반 효소 추출물(pectinase)에서 약 2.4배 증가했다고 보고하였으며 본 연구 결과를 뒷받침해 주는 결과이다. 물과 효소를 동시에 첨가하여 전처리한 처리구(GP3-4)에 비해 효소만 첨가하여 전처리한 처리구(GP3)의 6-G 및 Total 함량 값이 더 높게 나타났다. 이는 생강 착즙박에 P를 혼합하는 과정에서 수분과 온도 등 효소 활성이 극대화될 수 있는 적절한 환경이 조성되어 가수분해 및 추출 효율이 향상된 것으로 판단된다. 이와 같은 결과로 효소만 첨가하여 전처리하는 공정이 효소와 물을 동시첨가하여 진행하는것보다 수용화 특성 및 기능성분 추출에 효과적인 것으로 확인되었다.
효소 전처리 시간에 따른 생강 착즙박 수용화 특성 측정 결과는 Table 11에 나타냈다. WSI는 24시간 효소 전처리한 GP3가 7.52%로 다른 처리구들에 비해 낮게 나타났고 WAI는 13.70 g/g으로 가장 높게 나타났다. WAI값의 감소는 세포벽 분해효소 처리에 의해 고분자 탄수화물이 유리화되기 쉬운 구조로 전환되는데 효소처리 시간이 늘어날수록 세포벽 구조는 더 느슨한 형태가 된 것이다. 또한 열처리에 의해 물에 대한 용해도가 증폭됨으로써 추출하기 용이한 형태로 바뀌면서 수분을 흡수하는 힘이 약해졌기 때문으로 사료된다.
| Samples | Pretreatment time (h) | WSI1) | WAI |
|---|---|---|---|
| GP3 | 2 | 8.92±0.43a2) | 11.67±0.32b |
| 4 | 8.99±0.29a | 11.96±0.77b | |
| 10 | 8.97±0.29a | 11.94±0.52b | |
| 24 | 7.52±0.28b | 13.70±0.24a | |
| F-value | 12.225**3) | 10.180** | |
효소 전처리 시간에 따른 생강 착즙박 기능성분 함량 측정 결과는 Table 12와 같다. TP 함량은 전처리 10시간까지는 유의적인 차이가 없었고, 24시간 전처리하였을 때 유의적으로 가장 높게 나타났다(1.75 mg GAE/g). TF 함량 또한 TP와 유사한 경향을 보였으며 GP3가 0.42 mg CE/g으로 다른 처리구에 비해 약 1.2–1.3배 증가한 것으로 나타났다. Park et al. (2019)의 진피 효소 처리물의 항산화 활성 연구에서는 Viscozyme, Pectinex를 이용하여 효소 처리물을 제조하였는데 효소 처리 반응시간(60, 120, 180분)이 증가함에 따라 TP, TF 함량값도 증가하였다고 보고하였으며 본 연구 결과와 유사하였다. 항산화 함량값의 증가 또한 P 처리에 의해 페놀화합물이 수용화 하기 쉬운 형태가 되었기 때문에 증가한 것으로 판단된다. 페놀 화합물은 phenolic ring을 가지고 있어 free radical을 안정화시킬 수 있기 때문에 매우 높은 항산화 활성을 가진다고 알려져 있다(Cho et al., 2018). 효소 처리를 함으로써 생강 착즙박의 세포벽 구성성분이 분해되면서 유리 페놀산 함량이 증가한 것으로 보이며 24시간 동안 효소 전처리하는 방법이 효소 활성을 증가시키는 효과적인 처리시간임을 확인하였다(Moore et al., 2006).
1) TP, total polyphenol content; TF, total flavonoid content; GAE, gallic acid equivalent; CE, catechin equivalent; 6-G, 6-gingerol; 8-G, 8-gingerol; 10-G, 10-gingerol; 6-S, 6-shogaol; 8-S, 8-shogaol; 10-S, 10-shogaol; Total, sum of the 6, 8, 10 gingerol and 6, 8, 10 shogaol.
6-G은 56.17–83.61 mg/100 g의 함량 범위 정도를 보였으며 24시간 효소 전처리한 GP3가 83.61 mg/100 g으로 처리구 중에서 유의적으로 가장 높았다. 지표성분의 총합(Total) 또한 유사한 경향을 나타냈으며 GP3가 86.28 mg/100 g의 함량 값을 나타내 유의적으로 가장 높게 나타났다. 6-G 및 Total 함량값의 증가는 세포벽 분해 효소 처리를 통해 기능성분 물질의 추출 효율을 증가시켰기 때문이라고 생각하며 앞서 살펴본 24시간 효소 전처리구에서의 가장 높은 TP, TF 함량값의 증가와 유사한 경향성으로 나타났다. 결과적으로 기능성분 추출에 가장 효과적인 효소 전처리 시간은 24시간으로 선정하였다.
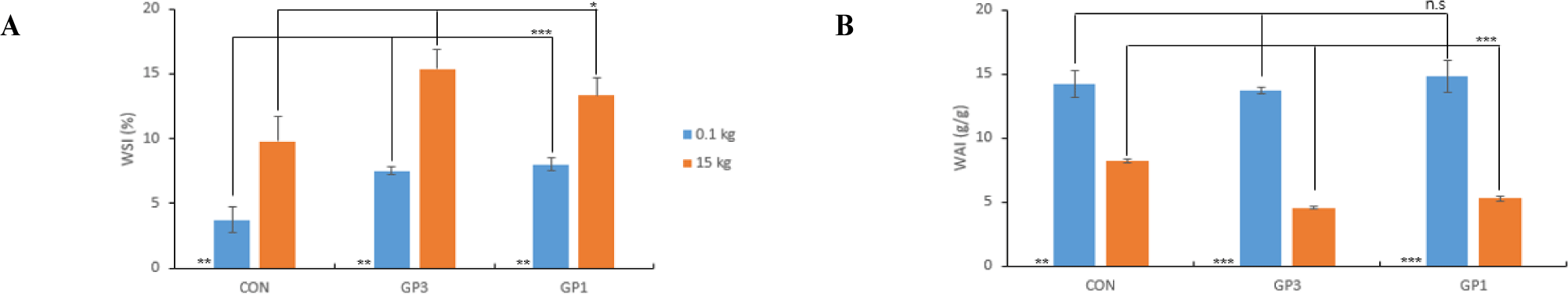
생강 착즙박 용량별 추출에 따른 수용화 특성 및 기능성분 함량 측정 결과는 Fig. 3–5에 나타냈다. WSI는 대조구(CON) 대비 효소 처리구(GP3, GP1)가 약 1.4–2.1배 증가하였고, 처리용량에 따라서는 유사한 경향이었다(Fig. 3A). WAI는 대용량으로 처리했을 때 CON, GP3, GP1 모두 1.7–3배 정도 유의적으로 감소하는 경향을 보였다(Fig. 3B). Kim et al. (2024b)은 오디에 pectinase를 이용하여 추출했을 때 소용량(0.1 kg)보다 대용량(4 kg) 추출물에서 WSI는 대조구보다 효소 처리구가 더 높아졌고 WAI는 더 낮아졌다고 보고하였는데 본 연구 결과와 일치하는 경향이었다. 이러한 결과는 효소가 생강 착즙박을 분해하여 추출률을 높이는데 효율적으로 작용한 것으로 보인다.
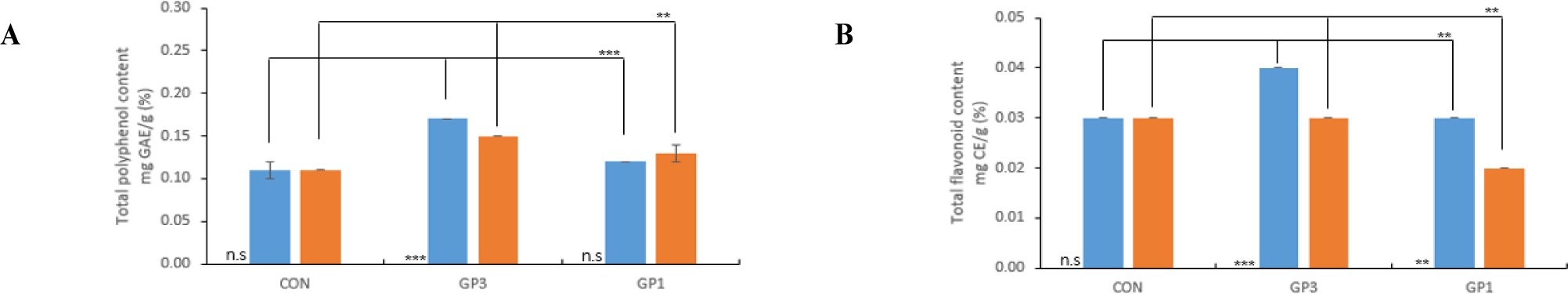
TP 함량은 소용량 및 대용량으로 처리했을 때 CON보다 효소 처리구에서 1.4–1.5배 증가하였고(Fig. 4A), TF 함량은 소용량에서는 CON에 비교하여 GP3는 1.3배 증가하였고, 대용량에서는 차이가 없었다(Fig. 4B). Nam et al. (2020)의 생강 효소 처리 농축액을 활용한 젤리제조 연구에서 생강을 대용량(12 kg) 효소 처리(polygalacturonase→α-amylase)했을 때 효소추출액은 대조구보다 WSI, TP에서 각각 2.7, 2.2배 증가하였다고 보고하였다. 이는 본 연구 결과와 유사한 경향으로, 효소 처리를 통해 생강 착즙박의 세포벽 구조가 변화되어 폴리페놀 등 유용성분의 추출량에 영향을 미칠 수 있음을 확인하였다. 또한, 대용량 처리 시에도 수용화 및 기능 성분 함량이 증가하여 산업적 적용 가능성이 있을 것이라 생각된다.
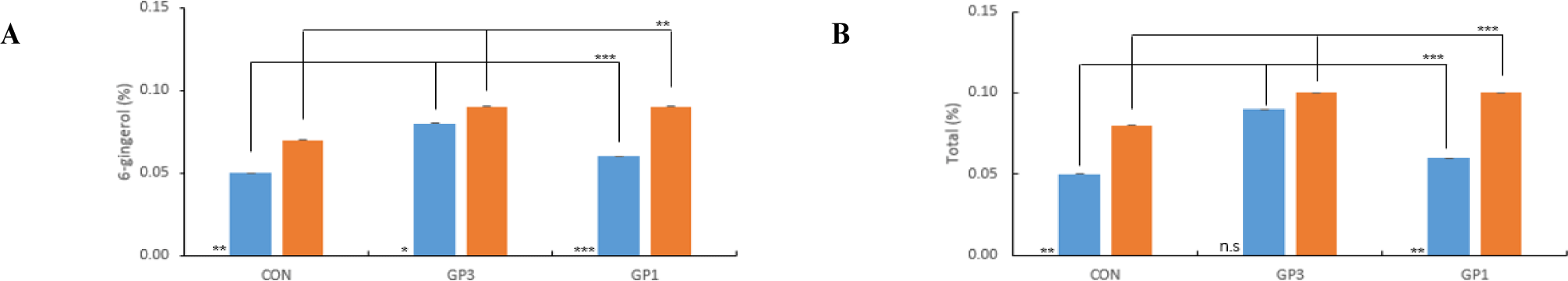
지표성분 함량 분석 결과, 6-G은 소용량보다 대용량으로 처리했을 때 GP3, GP1 모두 유의적으로 증가하는 경향을 나타냈다(Fig. 5A). Total 함량은 소용량 대비 대용량으로 처리했을 때 처리구 모두 증가하는 경향을 나타냈고, 대용량 처리에서는 CON보다 GP3, GP1에서 약 1.3배 높게 나타났다(Fig. 5B). Kim et al. (2023b)은 생강의 기능성분 대량 추출 연구에서 생강 분말의 소량 및 대량추출 과정에서 획득한 생강 헥산 분획물의 6-G 및 Total 함량이 lab- scale 추출(0.2 kg)보다 pilot-scale로 추출(60 kg)했을 때 증가하였다고 보고했으며 본 연구결과와 유사한 경향을 나타냈다. 따라서 개발된 효소 전처리 기술은 생강 착즙박의 대용량 추출에 적합하며, 대량 생산 및 산업적 활용이 가능할 것으로 기대된다.
요 약
본 연구는 효소 처리 방법을 적용하여 제조한 생강 착즙박 추출물의 수용화 특성 및 유용성분 추출 수율을 증진시키는 최적 효소 처리 조건을 선정하고, 대용량 생산 적용 가능성을 확인하고자 하였다. 효소 처리에 사용한 효소는 세포벽 분해효소인 P와 전분분해효소인 T를 이용하였고, P 처리 방법 및 가수 방법을 변형하여 진행하였다. 효소 처리 및 추출 조건에서는 CON 대비 GP3에서 WSI는 2배 이상 증가하였고, TP 및 TF 함량은 각각 1.6, 1.4배 증가하였다. 6-G 및 Total 함량은 1.7배 증가하는 것으로 나타났다. 효소 전처리 방법에서는 GP3에서 TP 함량 값이 가장 높았고, 6-G 및 Total 함량 또한 유의적으로 가장 높게 나타났다. 효소 전처리 시간에서는 P를 24시간 전처리했을 때 TP, TF, 6-G 및 Total 함량에서 유의적으로 가장 높게 나타나 효소 전처리 최적 조건을 선정하였다. 선정된 효소 전처리 기술(25℃, 24시간)을 활용하여 생강 착즙박 추출물을 용량별(0.1, 15 kg)로 제조하여 비교한 결과, WSI는 CON 대비 효소 전처리구(GP3)와 효소 처리구(GP1) 모두 증가하였고, 처리 용량에 따라서도 같은 경향을 나타냈으며 GP3가 가장 높았다. WAI는 대용량으로 처리했을 때 GP3가 가장 낮았다. TP는 소용량 및 대용량 모두 CON 대비 GP3가 가장 높았고, TF는 소용량에서는 CON 대비 GP3가 가장 높았지만, 대용량에서는 차이가 없었다. 6-G 측정 결과 소용량보다 대용량으로 처리했을 때 GP3, GP1 모두 유의적으로 증가하였고, Total 함량은 소용량에서는 CON 대비 GP3가 1.7배 높아졌으며 대용량에서는 약 1.3배 증가하였다. 결과적으로 생강 착즙박에 효소 전처리 방법을 적용하는 것은 수용화 증진 및 유용성분 추출 함량을 증대시킬 수 있는 단순 공정의 유용한 기술로 사용될 수 있을 것이라고 판단된다. 또한 용량별 효소 처리 추출물의 기능성분 함량 비교결과를 통해 생강 착즙박의 산업적 대량 생산을 위한 추출 공정 적용 가능성을 확인하였으며, 이를 통해 부가가치 향상 및 기능성 소재로서의 가능성을 제시하였다.