서 론
Terminalia bellirica (터미나리아 베리리카)는 바헤다(baheda), 베하다(behada), 벨레릭(beleric) 또는 바스타드 마이로발란(bastard myrobalan)으로 알려져 있는 사군자과(Combretaceae)에 속하는 큰 낙엽수로, 남아시아와 동남아시아의 평야와 낮은 언덕에서 흔히 볼 수 있으며, 가로수로도 재배된다(Meena et al., 2010; Bhanwase et al., 2023). 정확한 학명은 Terminalia bellirica (Gaertn.) Roxb.이고, 인도, 파키스탄, 네팔, 방글라데시, 스리랑카 등 동남아시아에서 가장 오래된 약용 식물 중 하나이다(Ayoob et al., 2014; Gupta et al., 2020). 이 나무의 약용 효능은 Unani, Siddha 및 Traditional Chinese Medicine 등 다양한 전통 의학 체계에 기록되어 있다(Abraham et al., 2014; Sharma et al., 2021). T. bellirica의 꽃, 나무껍질, 열매, 씨앗 속 알맹이는 변비 완화, 심장병 치료, 눈 염증 치료, 모발 강화, 목소리 보호, 혈액 정화, 인후통과 기침 완화, 위장 및 간 질환 등에 전통적으로 사용되어 왔다(Deb et al., 2016; Gupta et al., 2017).
그러나 T. bellirica의 이와 같은 생리학적 효능을 뒷받침하는 과학적 근거 자료는 제한적이며, 최근 들어서야 in vitro 및 in vivo 수준에서 항산화, 항염, 면역 조절, 항균, 간 보호, 신장 보호, 항당뇨, 항고지혈증 및 항암 작용을 포함한 다양한 생물학적 및 약리학적 효과에 대한 연구가 보고되고 있다(Latha & Daisy, 2011; Dharmaratne et al., 2018; Tanaka et al., 2018; Patra, et al., 2020). T. bellirica의 이러한 생리활성은 glucoside, tannins, gallic acid, corilagin, ellagic acid, ethyl gallate, galloyl glucose, chebulagic acid 및 arjunolic acid 등의 다양한 생리활성 화합물이 함유되어 있기 때문으로 여겨진다(Kumari et al., 2017; Kumar & Khurana, 2018). 그러나 T. bellirica의 생리활성에 대한 체계적 연구와 동물 및 임상수준에서의 연구는 아직 초기 단계이며, 생리활성 성분에 대한 규명 및 안전성 연구 또한 미흡한 실정이다.
본 연구에서는 T. bellirica 추출물의 생리활성을 특히 항산화 효과에 초점을 두어 시험관과 세포수준에서 연구하고자 하였으며, 주요 생리활성 성분, 세포독성 및 잠재적 유전독성을 규명하고자 하였다.
재료 및 방법
T. bellirica는 대한켐텍㈜에서 제공받아 70% 에탄올(10 g/200 mL)로 40℃에서 30분간 bath sonicator (Bransonic 5800, Branson Ultrasonics, Danbury, CT, USA)를 이용하여 추출하여 사용하였다.
추출물의 총 폴리페놀 함량은 Folin-Denis법(Appel et al., 2001)에 의하여 분석하였다. 추출물 80 µL (156 µg/mL)에 50% Folin-Ciocalteu 시약(Sigma-Aldrich, St. Louis, MO, USA) 20 µL를 가하여 암소에서 5분 동안 반응시킨 후 2% Na2CO3 (Samchun Pure Chemical Co., Ltd.) 100 µL를 가하였다. 30분간 암소에서 반응시킨 후에 microplate 판독기(SpectraMax® M3, Molecular Devices, Sunnyvale, CA, USA)를 이용하여 750 nm에서 흡광도를 측정하였다. 총 폴리페놀의 함량은 tannic acid (Sigma-Aldrich)를 표준물질로 이용하여 도출한 표준곡선으로부터 계산하였다.
총 플라보노이드 함량은 Zhishen et al. (1999)의 변형된 방법에 따라 측정하였다. 추출물 50 µL에 5% NaNO2 (Sigma-Aldrich) 30 µL를 가한 다음, 5분 후 2% AlCl3·6H2O (Sigma-Aldrich) 60 µL를 첨가하여 암소에서 6분간 반응시켰다. 이후 1 N NaOH (Duksan Pure Chemicals Co., Ltd., Ansan, Korea) 100 µL를 첨가하여 11분 동안 반응시킨 뒤 510 nm에서 흡광도를 측정하였다(SpectraMax® M3, Molecular Devices). 총 플라보노이드의 함량은 (+)-catechin (ENZO Life Sciences, Farmingdale, NY, USA)을 표준물질로 이용하여 도출한 표준곡선으로부터 계산하였다. 총 폴리페놀 및 총 플라보노이드 함량 측정 모두 동량의 curcumin (Sigma-Aldrich, ≥65% curcumin 함량) 제품을 양성 대조군으로 이용하여 비교하였다.
추출물 0.1 g에 15 mL distilled water (DW)를 가하고, 수욕조에서 30분 동안 중탕하여 가열한 후 원심분리(1,200×g, 20분)하였다. 상등액 0.1 mL에 7.5 mL DW를 첨가하고, 0.5 mL 1 N Folin-Ciocalteau (Sigma-Aldrich) 시약과 1 mL의 35% Na2CO3 (Sigma-Aldrich) 수용액을 가하였다. DW를 이용하여 총 10 mL의 부피가 되도록 제조한 후 30분간 반응시켰다. 이 용액의 흡광도를 700 nm에서 분석하였고(SpectraMax® M3, Molecular Devices), tannic acid (Sigma-Aldrich) 표준용액을 0, 5, 10, 20, 25 ppm으로 제조한 후 동일한 방법으로 분석하여 도출한 표준곡선으로부터 추출물의 총 탄닌산 함량을 정량하였다.
2,2'-azinobis-(3-ethyl-benzothiazoline-6-sulfonic acid) (ABTS; Sigma-Aldrich)를 이용한 추출물의 항산화 활성 측정은 다음과 같이 진행하였다(Lee et al., 2009; Lee et al., 2015). 10 mM ABTS와 10 mM K2S2O8을 7.4:2.6 (v/v)의 비율로 혼합한 후, 37℃ 암소에서 24시간 동안 반응시켜 ABTS 라디칼을 형성하고, 인산완충용액(phosphate buffered saline, PBS)으로 734 nm에서 0.650±0.020의 흡광도가 되도록 희석하였다. 추출물 50 µL에 희석한 ABTS 라디칼 용액 150 µL를 가하여 상온의 암소에서 30분간 반응시킨 후 734 nm에서 흡광도를 측정하였다(SpectraMax® M3, Molecular Devices).
2,2-diphenyl-2-picrylhydrazyl (DPPH; Alfa Aesar, Wardhill, MA, USA) 라디칼 소거능을 분석하여 추출물의 항산화 활성을 측정하였다(Lee et al., 2009). 즉, 메탄올로 600 µM의 DPPH 용액을 제조한 뒤, 80% (v/v) 메탄올을 이용하여 517 nm에서 0.65±0.02의 흡광도가 되도록 희석하였다. 각 추출물 100 µL와 희석한 DPPH 용액 100 µL을 혼합하여 암소에서 30분간 반응시킨 후 517 nm에서 흡광도를 측정하였다(SpectraMax® M3, Molecular Devices). 각 추출물의 항산화 활성은 L-ascorbic acid (Samchun Pure Chemical Co., Ltd.)에 해당하는 항산화력으로 나타내었다.
본 실험에서 사용한 장관상피세포인 Caco-2 세포는 한국세포주은행(Korean Cell Line Bank, Seoul, Korea)에서 분양받아 minimum essential medium (Welgene Inc., Gyeongsan, Korea)에서 배양하였으며, 각 배지에는 10% 열 불활성화 소태아혈청(heat inactivated fetal bovine serum), 페니실린(100 units/mL) 및 스트렙토마이신(100 µg/mL)을 첨가하여 5% CO2, 37℃ 조건의 세포배양기에서 배양하였다.
세포 내 활성산소종(reactive oxygen species, ROS) 측정은 세포막 투과성 2',7'-dichlorofluoroescein diacetate (H2DCFDA; Molecular Probes Inc., Eugene, OR, USA)를 이용하여 분석하였다. Caco-2 세포(1×104 세포/100 µL)를 배양하여 추출물에 21시간 처리 후 200 µM 과산화수소(H2O2, Sigma-Aldrich)를 첨가하여 3시간 반응시켜 총 24시간 배양하였다. 양성대조군으로는 curcumin 제품(Sigma-Aldrich)을 이용하였는데, 예비실험에서 세포독성이 나타나지 않는 10 µg/mL의 농도로 처리하였다. 총 24시간 동안 처리 후 각 well에 20 µM H2DCFDA 100 µL을 첨가하여 30분간 암소에서 반응시킨 뒤, dimethyl sulfoxide (Sigma-Aldrich) 100 µL 첨가하여 excitation 파장 485 nm와 emission 파장 535 nm에서 형광을 측정하였다(SpectraMax® M3, Molecular Devices).
세포 내 항산화효소 catalase (CAT)와 superoxide dismutase (SOD)의 활성을 CAT 분석 키트(BioMax, Guri, Korea)와 SOD 분석 키트(Cayman Chemical Co., Ann Arbor, USA)를 이용하여 각각 분석하였다. Caco-2 세포(1×106 세포/2 mL)를 추출물에 21시간 처리 후 200 µM 과산화수소(Sigma-Aldrich)를 첨가하여 3시간 반응시켜 총 24시간 배양하였다. 두 가지 항산화효소 활성은 제조사의 프로토콜에 따라 3반복 분석하였다. 양성대조군으로 10 µg/mL의 curcumin 제품을 이용하여 비교하였다.
추출물의 Caco-2 세포에 대한 독성은 water-soluble tetrazolium salt-1 (WST-1; Roche, Basel, Switzerland)을 이용하여 세포성장 저해 효과를 평가하였다. Caco-2 세포(1×104 세포/100 µL)를 배양한 후 추출물을 각각 6시간 또는 24시간 동안 연속 처리하였다. 유전독성시험과 동일하게 6시간 처리군의 경우 대사활성계 S9 mix 존재 유무(+S9 mix, –S9 mix)에 따라 비교 평가하였다(Lee et al., 2019; Kim et al., 2021). S9 mix는 S9 fraction (rat liver S9 homogenate in KCl, MP Biomedicals, CA, USA)과 cofactor (Cofator Ⅲ, Genogen Co. Ltd, Cheongju, Republic of Korea)를 2:4.7의 비율로 혼합하여 최종 농도 1.5%로 제조하였다. 대사활성계를 첨가하여 6시간 배양한 경우, S9 mix에 의한 세포독성 영향을 최소화하기 위하여 이를 제거 후 18시간 동안 회복기를 두고 분석하였다. WST-1 시약 10 µL을 각각 첨가하고 4시간 동안 배양한 후 440 nm에서 흡광도를 microplate reader (SpectraMax® M3, Molecular Devices)를 이용하여 측정하였다.
Caco-2 (1×106 세포/2 mL)에 추출물을 처리하여 6시간 또는 24시간 동안 연속처리한 후 PBS로 세척하고, PBS에 제조한 5 mM ethylene-diamine-tetraacetic acid 용액 1 mL로 40초 동안 처리하여 스크래퍼를 이용해 회수하였다. 대사활성계 영향을 평가하기 위하여 6시간 처리시 S9 mix 존재 유무(+S9 mix, –S9 mix)에 따라 비교 평가하였으며, S9 mix 처리한 경우 18시간 회복기를 두고 comet 분석을 진행하였다. 스크래퍼를 이용하여 회수한 세포를 원심 분리하여 차가운 PBS에 다시 현탁(1×105 세포/1 mL)하였다. 유전독성 양성대조군으로 100 µM 과산화수소를 이용하였다. R&D Systems (Minneapolis, MN, USA)의 kit를 이용하여 제조사의 프로토콜에 따라 comet 분석을 수행하였다. 즉, 세포 현탁액을 저융점 한천과 1:10 (v/v) 비율로 혼합한 후, 75 µL를 comet 슬라이드에 즉시 적재하였다. 슬라이드를 4℃의 어두운 환경에서 30분간 방치하여 겔화(gelation)시킨 후, 4℃의 차가운 lysis 용액에 처리하였다. 1시간 후 lysis 용액을 제거하고, 슬라이드를 pH 13 이상의 알칼리 용액에 30분간 실온 암실에서 처리하였다. 알칼리 용액을 제거한 후, 슬라이드를 4℃의 암실에서 20 V, 300 mA의 조건으로 40분 동안 전기영동하였다. 슬라이드를 3차 증류수로 세척하고, 70% 에탄올에 5분간 처리한 후 건조시켜 4℃의 암실에서 100 µL의 Cygreen으로 30분 동안 염색하였다. 마지막으로, 슬라이드를 Axioskop 2 plus 형광현미경과 Cometscore 2.0 이미지 분석 소프트웨어(Carl Zeiss, Oberkochen, Germany)를 이용하여 분석하였다. 디지털 방식으로 comet tail의 길이를 분석하고, tail 내 DNA의 백분율(%)을 계산하였다(tail 내 DNA 양을 총 DNA 양으로 나눈 값).
결과 및 고찰
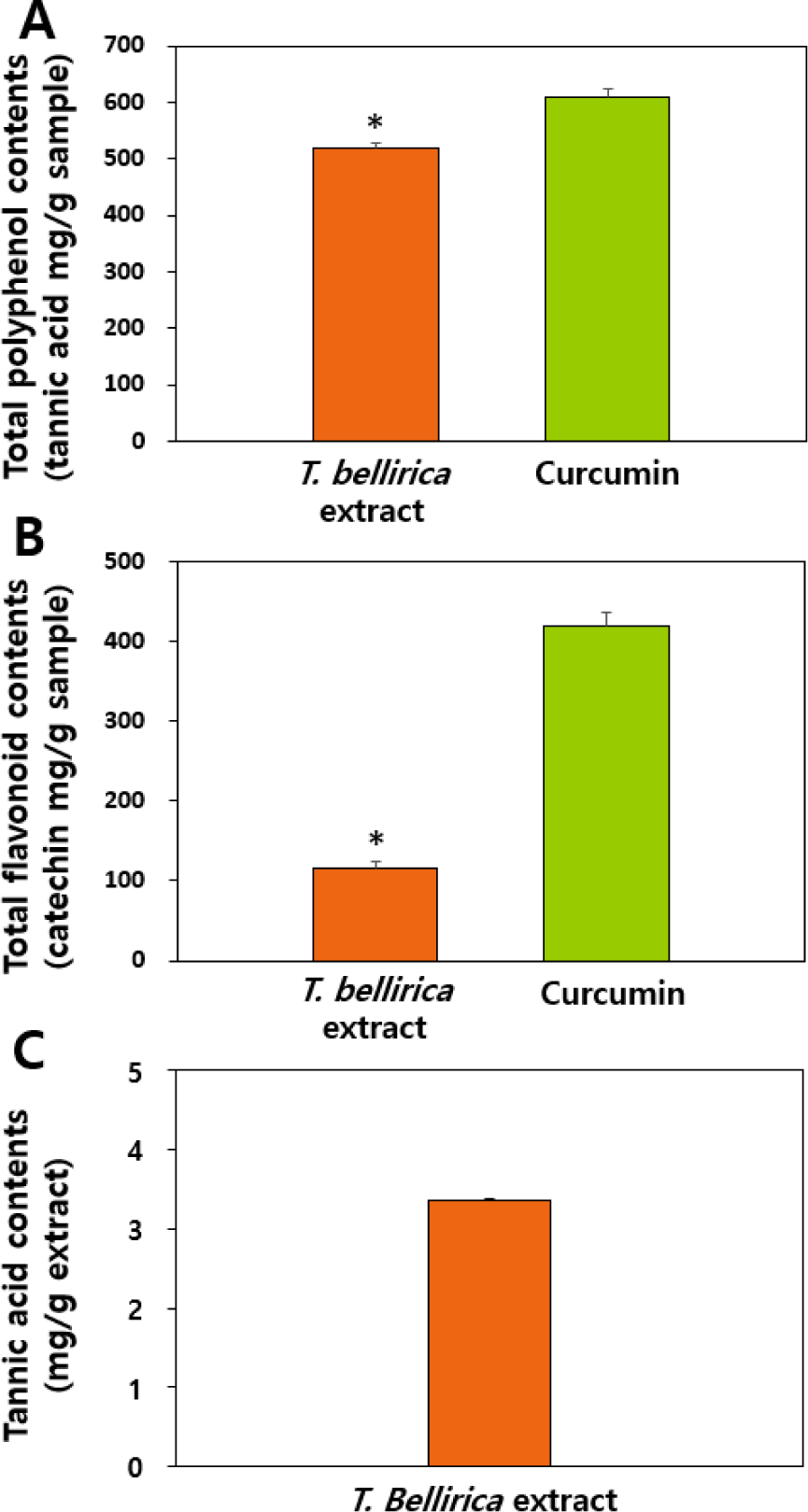
T. bellirica 추출물이 폴리페놀류를 다량 함유하고 있는 것으로 보고된 바 있어 총 폴리페놀과 총 플라보노이드 함량을 분석하였고, 강황에서 추출한 curcumin 제품(65% 이상 curcumin 함량)을 양성대조군으로 이용하였다(Fig. 1). 강황은 주된 성분이 폴리페놀류인 curcumin이지만, 그 이외 curcuminoid와 일부 플라보노이드 성분 또한 함유하고 있다(Fuloria et al., 2022). 그 결과, curcumin 제품보다 T. bellirica 추출물의 총 폴리페놀 함량은 유의적으로 낮았지만 상당한 수준의 폴리페놀류를 함유하고 있는 것으로 나타났으며, T. bellirica 추출물의 총 플라보노이드 함량은 curcumin 제품보다 약 1/3.5 수준으로 유의적으로 낮은 것으로 분석되었다(p<0.05). 즉, T. bellirica 추출물의 총 폴리페놀 함량 대비 총 플라보노이드 함량이 약 23%로 분석되었는데, 이러한 경향은 T. bellirica의 추출용매 종류 및 방법과 상관없이 선행 문헌들과 일치하는 경향이다(Arya et al., 2012; Rakholiya et al., 2015). 한편, 총 탄닌산 함량은 총 폴리페놀 및 총 플라보노이드 함량 대비 각각 1/25과 1/5.5 수준으로 낮은 것으로 분석되었고, 이 역시 기 보고된 문헌과 일치하는 결과이다(Arya et al., 2012). 즉, T. bellirica 추출물은 플라보노이드와 탄닌산 같은 폴리페놀을 주요 성분으로 함유하고 있음을 알 수 있다. T. bellirica 추출물에 함유된 폴리페놀 및 플라보노이드의 구체적 성분에 대한 정성 및 정량분석과 이와 관련된 생리활성 연관성 규명에 대한 연구가 향후 필요할 것이다.
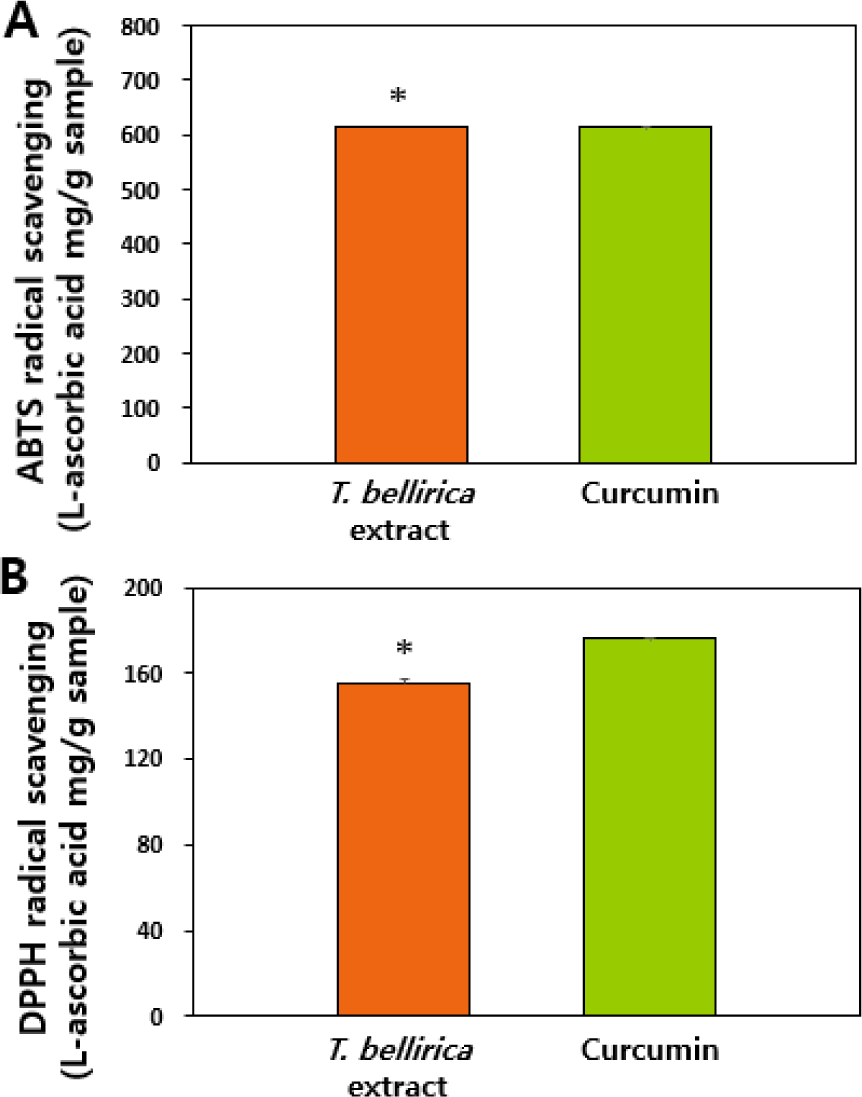
T. bellirica 추출물의 시험관 수준 항산화 활성을 ABTS와 DPPH 라디칼 소거능 분석을 이용하여 평가하였고, 라디칼 소거 활성이 잘 알려진 curcumin 제품을 양성대조군으로 이용하였다. 그 결과, T. bellirica 추출물의 ABTS 및 DPPH 라디칼 소거능이 확인되었으며(Fig. 2), 양성대조군 curcumin 제품과 유사한 정도의 항산화 활성을 보유하고 있는 것으로 보인다. T. bellirica 추출물의 항산화 효과는 선행 문헌에서도 보고된 바 있으며(Dharmaratne et al., 2018; Tanaka et al., 2018), 이는 Fig. 1의 결과에서 보듯이 다량의 폴리페놀 및 플라보노이드 화합물을 함유하고 있는 것과 상관관계가 있는 것으로 보인다(Hazra et al., 2010; Lobo et al., 2010; Elizabeth et al., 2017).
장관상피 Caco-2 세포에서 과산화수소 처리에 의한 ROS 유발 후 양성대조군인 curcumin 제품과 T. bellirica 추출물에 의한 ROS 소거능을 비교 평가하였다. 세포막 투과성 비형광 H2DCFDA는 세포 내에서 esterase 효소에 의해 가수분해되는데, ROS 존재 시 2’,7’-dichlorofluorescein (DCF)로 산화되어 형광을 나타내는 원리를 이용하여 측정하였다. 그 결과, 과산화수소 처리에 의해 발생한 ROS가 양성대조군 curcumin 제품에 의해 유의적으로 감소하는 것을 확인하였고, T. bellirica 추출물의 경우 19.5 µg/mL 이상의 농도에서 ROS를 대조군 수준으로 감소시키는 것으로 나타났다(Fig. 3A) (p<0.05). Curcumin 제품의 처리 농도(10 µg/mL)가 T. bellirica 추출물이 유의적 ROS 소거능을 보이는 19.5 µg/mL보다 낮은 점을 고려하면 양성대조군보다는 낮은 ROS 소거 활성을 보이나, T. bellirica 추출물이 농도 의존적으로 ROS 소거 활성을 보유하고 있음을 알 수 있다.
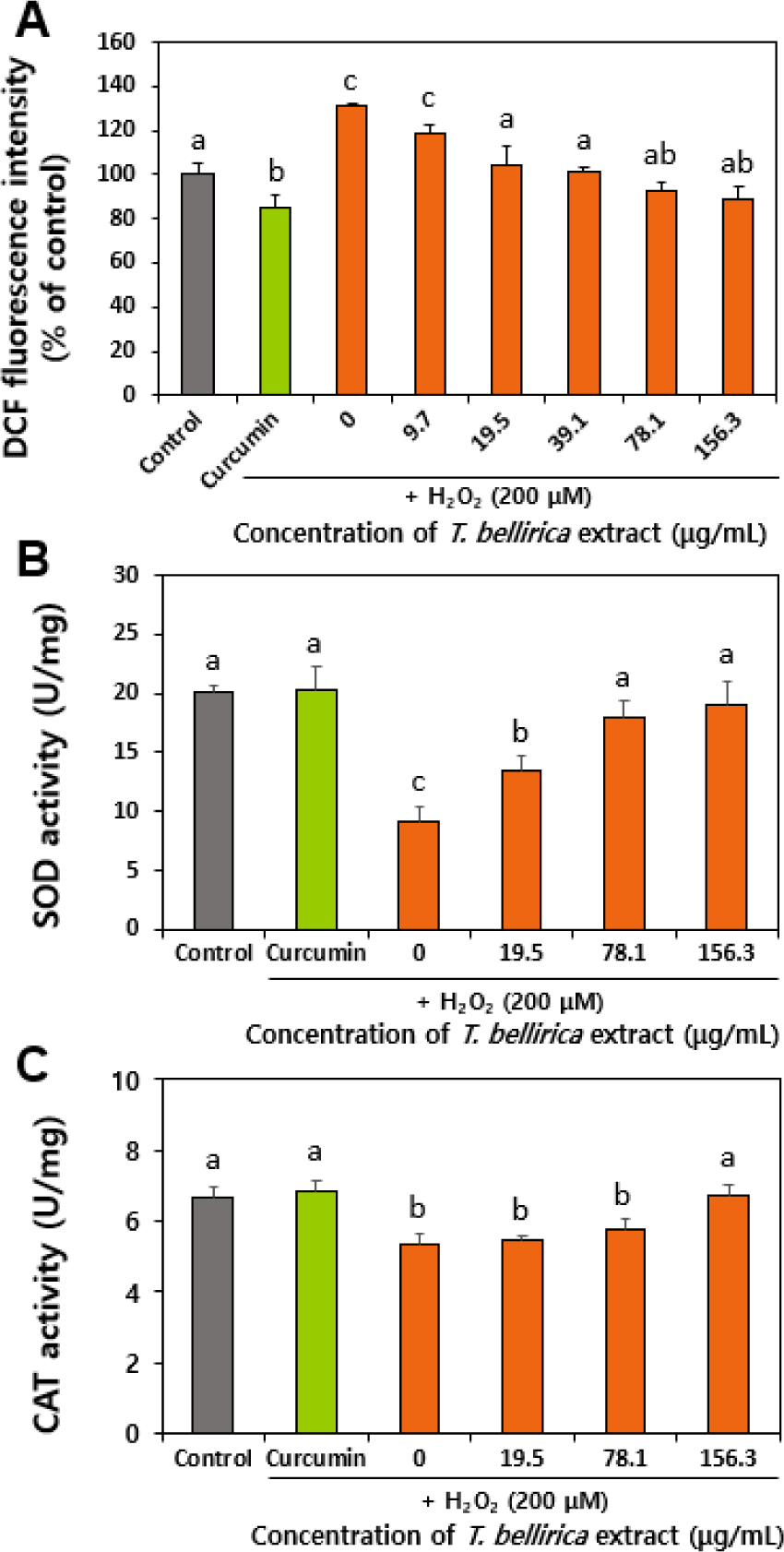
한편, ROS를 제거하기 위해 활성화되는 항산화효소로서 대표적인 CAT와 SOD 활성을 비교 분석하였다. CAT는 과산화수소를 물과 산소로 분해하는 역할을, SOD는 superoxide 라디칼(O2·–)을 과산화수소와 산소로 변환시키는 과정을 촉매 함으로써 ROS로 인한 산화스트레스로부터 방어하는 역할을 한다(Nandi et al., 2019; Jomova et al., 2024). Fig. 3B와 C에서 보듯이 T. bellirica 추출물을 처리한 경우, 과산화수소에 의해 유발된 ROS를 제거하기 위해 CAT와 SOD의 활성이 농도 의존적으로 증가하는 것으로 나타났다. 이는 ABTS 및 DPPH 소거능 결과(Fig. 2)와 함께 T. bellirica 추출물의 항산화 기능성을 보여주는 결과이다. 국내에서 T. bellirica 추출물을 기능성 소재로 활용하고자 하는 연구는 아직 초기 단계이나, 항산화 기능성 원료로서의 개발이 기대된다.
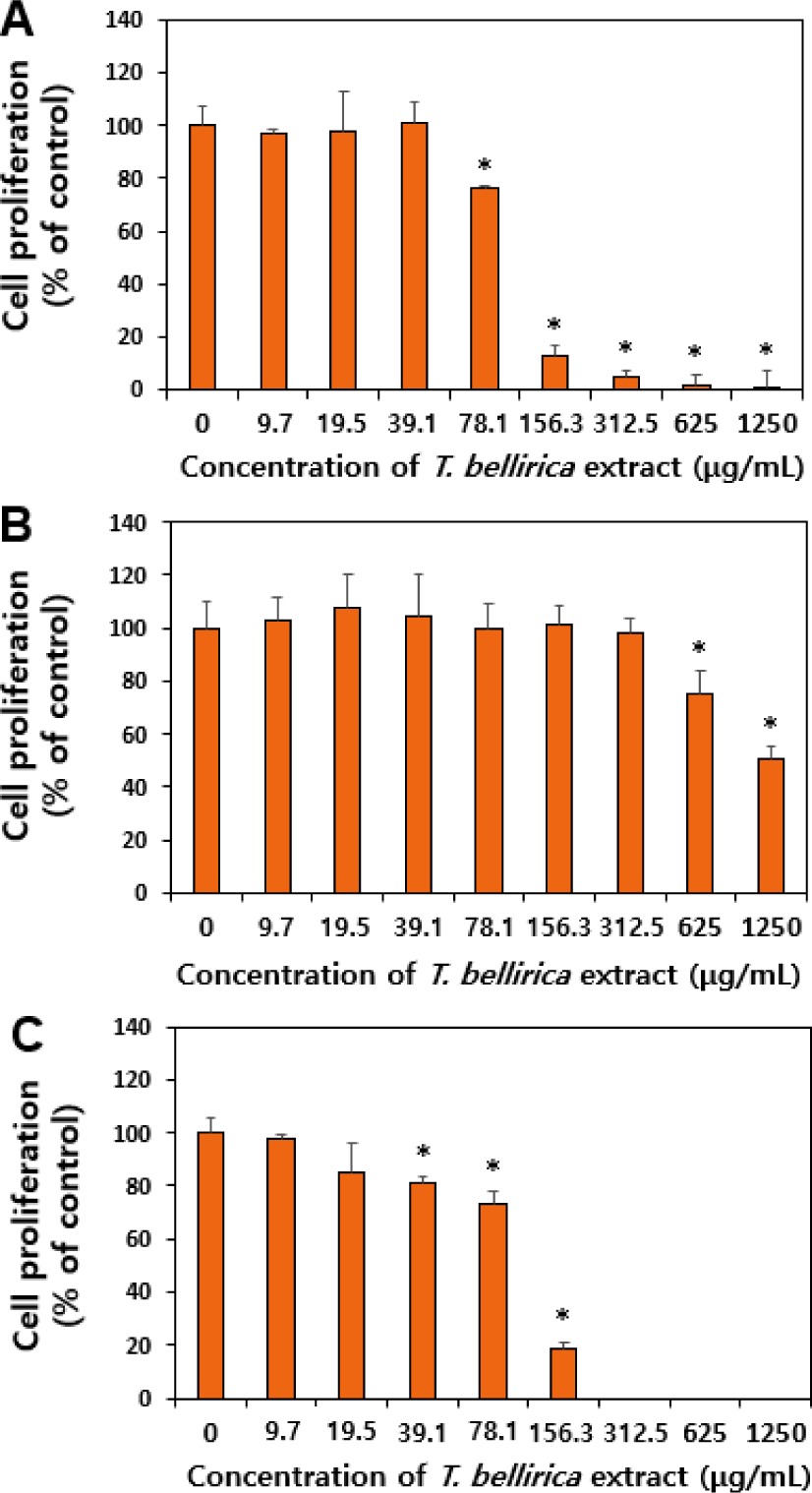
Caco-2에서 T. bellirica 추출물에 의한 세포성장 저해 효과를 WST-1 분석으로 평가하였다(Fig. 4). 노출시간은 장내 머무름 시간을 고려한 6시간과 지연된 노출을 고려한 24시간 두 가지 조건으로 설정하였다. 또한 대사과정을 거치면서 독성영향 정도가 달라질 수 있으므로 6시간 노출의 경우 대사활성계 S9 mix 존재 유무에 따라 세포성장 저해 효과를 비교하였다. 그 결과, 추출물에 6시간(–S9 mix)과 24시간 노출의 경우 각각 78.1 µg/mL과 39.1 µg/mL 농도에서부터 세포성장이 유의적으로 감소하여(p<0.05), 156 µg/mL 이상의 농도에서는 세포생존율이 매우 낮았다(Fig. 4A, C). 반면, 대사활성계 존재하 6시간 처리군(+S9 mix)의 경우, S9 mix를 첨가하지 않은 경우 대비 세포성장 저해 정도가 완화되어 625 µg/mL 이상의 농도에서 유의적 세포성장 저해 효과를 나타내었다(Fig. 4B)(p<0.05). 이러한 결과는 대사활성계 존재하 T. bellirica 추출물의 세포독성이 낮아질 수 있음을 의미하며, S9 mix에 존재하는 매트릭스 및 효소 등과 상호작용 또는 대사과정에서 효소에 의한 구조변화 등에 기인한 것으로 보인다(Soares et al., 2006). 즉, 대사과정을 거치면서 T. bellirica 추출물의 독성이 낮아질 것으로 유추할 수 있다. 한편, 고농도 T. bellirica 추출물의 세포성장 저해 효과는 다량의 폴리페놀을 함유하고 있기 때문으로 보이며, 고농도의 curcumin 및 catechin 등 폴리페놀 화합물들이 세포독성을 유발할 수 있음이 다수의 논문에서 기 보고된 바 있다(Şueki et al., 2019; Monika et al., 2023; Lakshminarayanan et al., 2025). 건강기능식품으로 녹차추출물의 일일섭취량이 (–)-epigallocatechin gallate 기준 300 mg이고, 한국인 평균 몸무게 55 kg를 고려하면 약 5.5 mg/g 수준으로 평가되므로(MFDS, 2021), 즉 T. bellirica 추출물의 세포독성은 폴리페놀 성분 섭취량 수준에서는 안전한 것으로 보인다.
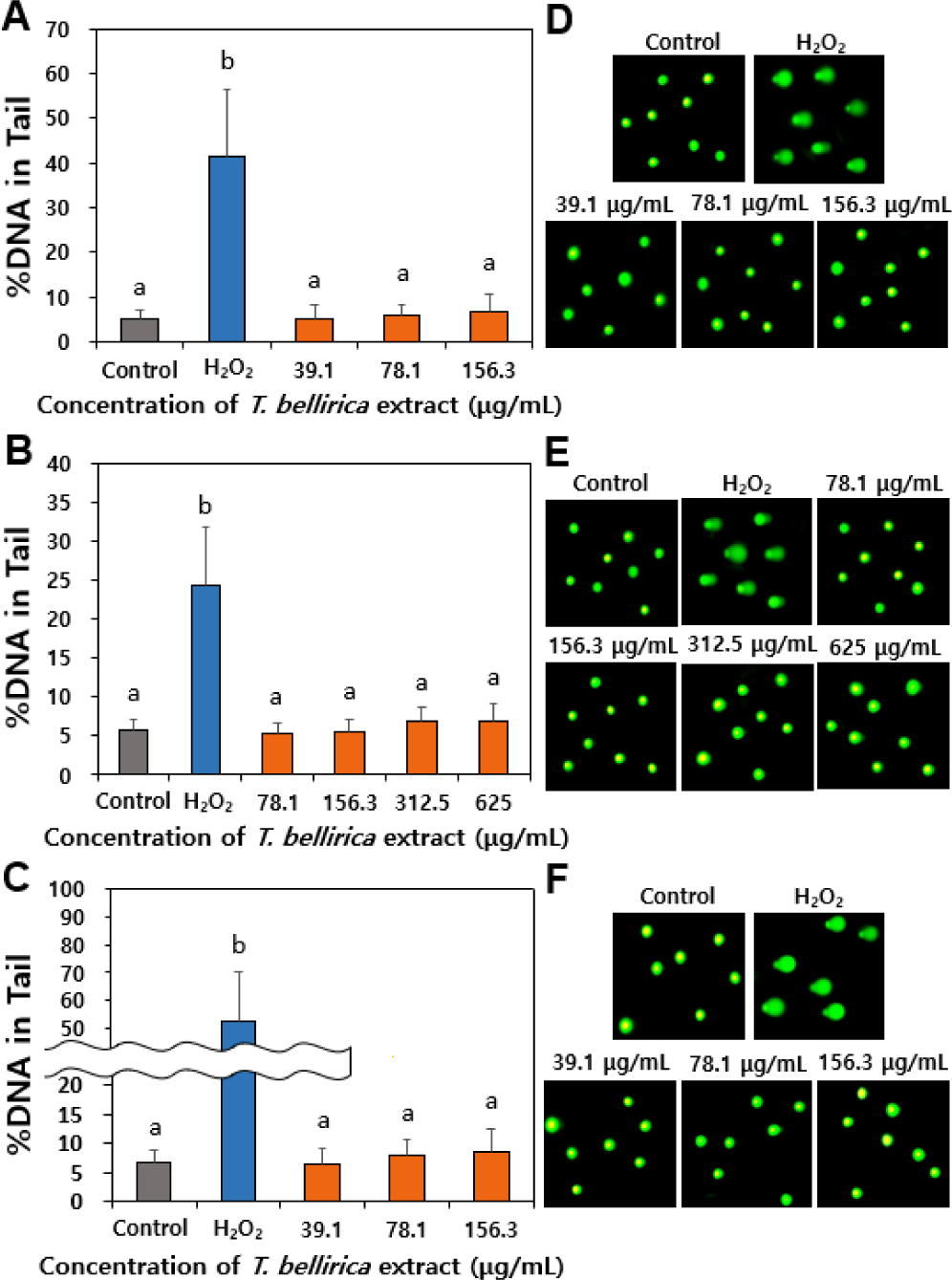
기능성 및 식품용 소재로 사용되기 위해서는 유전독성에 대한 안전성 정보가 필수적이므로, 세포수준에서 유전독성을 comet 분석을 이용하여 DNA tail 형성 여부를 평가하였고, 양성대조군으로 과산화수소를 이용하였다. Comet 분석은 단세포 겔 전기영동법(single-cell gel electrophoresis)을 이용하여 세포에서 단편화 된 DNA가 이동하는 정도를 분석하여 DNA 손상을 측정하는 방법이다. 이 분석법은 손상된 DNA가 전기영동 과정에서 온전한 DNA보다 더 빠르게 이동한다는 원리에 기반한다(Cordelli et al., 2021). 즉, 변성되고 절단된 DNA 단편 또는 손상된 DNA가 전기영동 과정에서 세포 밖으로 이동하여 comet tail을 형성하는 반면, 손상되지 않은 DNA는 세포막 내에 존재하여 comet head를 형성하는 원리이다. 유전독성시험의 최고 농도는 세포독성이 55±5%에 이르는 농도로 설정하도록 권고하므로(OECD, 2023), 156.3 µg/mL, 625 µg/mL 및 156.3 µg/mL를 6시간(–S9 mix), 6시간(+S9 mix) 및 24시간(–S9 mix) 처리군의 최고 농도로 각각 설정하였으며, 1,250 µg/mL 농도의 경우 침전물 생성으로 인해 이미지 관찰이 불가능한 점을 고려하여 제외하였다. Fig. 5에서 보듯이 6시간 및 24시간 처리군에서 모두 대사활성계(S9 mix) 존재 유무와 상관 없이 comet tail을 형성하지 않는 것으로 나타나, T. bellirica 추출물이 DNA 손상을 유발하지 않는 것으로 확인되었다. 유전독성은 복귀돌연변이시험, 염색체이상시험 및 소핵시험 세 가지 결과를 종합하여 결론을 도출하나, 본 연구에서 제시한 세포수준 comet 분석 결과는 유전독성에 대한 기초 정보를 제시한다. 또한 T. bellirica 추출물에 대한 초기 단계의 기능성 연구가 주를 이루고 있는 현 시점에서 유전독성 정보는 안전한 섭취를 위한 주요 자료로 활용될 수 있을 것이다.
요 약
본 연구에서는 동남아시아에서 오랫동안 약용 식물로 사용되어 오고 있는 T. bellirica 추출물의 생리활성을 항산화 기능성에 초점을 두고 연구하였다. 그 결과, T. bellirica 추출물은 플라보노이드 및 탄닌산과 같은 다량이 폴리페놀 성분을 함유하고 있는 것으로 분석되었고, 시험관과 세포수준에서 모두 ROS 소거 활성을 보이고 항산화효소 활성을 향상시키는 것으로 나타나, 항산화 기능성 소재로서 잠재력을 제시하였다. 아울러 실질적 섭취수준에서 세포성장을 저해하지 않고 DNA tail을 형성하지 않으므로, 잠재적 세포독성 및 유전독성 유발 가능성이 낮은 것으로 평가되었다. T. bellirica 추출물의 항산화 기능성에 대한 심도 깊은 연구 및 in vivo 수준에서의 독성 연구가 추가적으로 요구되나, 이와 같은 결과는 본 추출물을 안전한 수준에서 항산화 기능성 성분으로 활용하는데 기초자료로 활용될 수 있을 것이다.







