서 론
세이지(Salvia officinalis L.)는 꿀풀과(Lamiaceae)에 속하는 여러해살이 풀이다. 세이지는 천연 식품 및 가공식품의 보존, 감미료, 식용 색소 등 다양한 목적으로 사용된다(Ripke Ferreira et al., 2022). 또한 세이지는 육류와 어류의 산화 방지의 효과가 있어 보존의 목적으로 요리에 이용되는 향신료이다(Zhang et al., 2013). 세이지는 주로 잎과 부드러운 줄기를 사용한다. 세이지에는 로즈마린산, 루틴 등의 플라보노이드와 캠퍼, 보르네올, 유칼립톨(1,8-cineole)과 같은 테르펜류가 다량 함유되어 있다(Ghorbani et al., 2017).
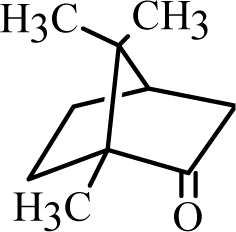
세이지에 함유되어 있는 대표적인 테르펜류 중 하나인 캠퍼는 게라닐 다이포스페이트(Geranyl diphosphate)에서 식물의 생체 변환을 통해 생합성된 보르네올이 가수분해되어 생성된다(Chen et al., 2013). 캠퍼는 1,7,7-trimethylbicyclo (2.2.1) heptan-2-one인 구형에 가까운 구조를 가지고 있으며, 구조적인 특성으로 높은 온도에서 비교적 안정성을 가진다고 알려져 있다(Andersson et al., 1990). 캠퍼는 항균, 항진균 활성, 바이러스 활성 억제, 항진통 등 다양한 증상을 치료하는 데 세계적으로 사용되고 있으며, 암세포의 억제 및 항유전자 효과 또한 가지고 있는 것으로 알려져 있다(Perry et al., 2003).
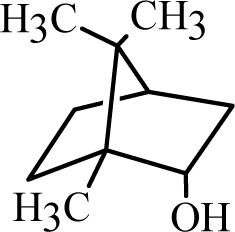
보르네올(Borneol)은 모노테르펜으로 아이소프렌 두 개로 구성되어 있다. 보르네올 또한 게라닐 다이포스페이트에서 식물 생체 변환을 통해 합성된다. 보르네올의 구조는 1,7,7-trimethylbicyclo (2.2.1) heptan-2-ol로 캠퍼에서 수소 원자 하나가 산소원자에 결합된 형태이다. 보르네올은 캠퍼와 동일한 구형에 가까운 구조를 가지고 있으며, 캠퍼보다 높은 녹는점을 가진다. 보르네올은 주로 용뇌수, 녹나무에 함유된 것으로 알려져 있다(Mei et al., 2023). 보르네올은 식품, 담배, 향수 및 화장품 산업에서도 사용된다(Bhatia et al., 2011). 보르네올은 γ-아미노부티르산의 조절 효과(Tambe et al., 2016), 심혈관질환의 효과(Liu et al., 2021), 항염 효과가 있는 것으로 알려져 있다(Yu et al., 2019).
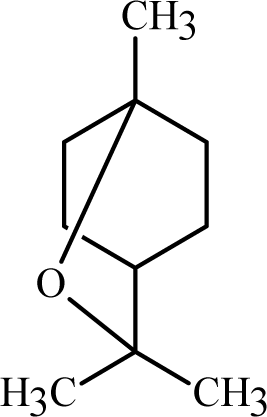
유칼립톨(Eucalyptol)은 1,8-시네올(1,8-Cineole)이라고도 불리는 모노테르페노이드이다. 무색으로 상쾌하고 민트와 같은 향기가 있는 것으로 알려져 있다. 유칼립톨은 주로 유칼립투스 나무에 많이 함유되어 있으며, 유칼립투스 잎의 90% 이상의 함량을 나타낸다(Aparicio et al., 2007). 유칼립톨은 항돌연변이성(Mitić-Ćulafić et al., 2009), 항염증(Juergens et al., 2003) 및 살충(Sukontason et al., 2004)의 효과가 있는 것으로 알려져 있다. 세이지에 함유되어 있는 대표적인 유효성분의 화학적인 구조 및 특성을 Table 1에 나타내었다.
| Compounds | Chemical structure | Molecular formula | Melting point (°C) | Boiling point (°C) |
|---|---|---|---|---|
| Camphor |
|
C10H16O | 175-177 | 209 |
| Borneol |
|
C10H18O | 2.9 | 176 |
| Eucalyptol |
|
C10H18O | 208 | 213 |
현재 웰빙과 건강에 대한 소비자의 관심 증가로 고부가가치 화합물 및 기능성 성분의 추출에 대한 관심이 높아지고 있다(Hosni et al., 2017). 추출의 목적은 추출하고자 하는 유효성분의 추출 수율을 최대화하고 불순물이나 바람직하지 않은 화합물의 추출은 최소화해야 한다(Garacia-Vaqiero et al., 2018).
아임계수 추출 기술이란 물의 임계점(374°C, 22 MPa)보다 낮은 상태의 물인 아임계수를 이용하는 추출 기술로 온도와 압력에 의존적인 물의 유전상수율의 성질을 이용한 것이다(Herrero et al., 2013). 물은 ε=79의 유전상수율을 가지고 있으나, 250°C의 온도와 5 MPa의 압력인 조건에서의 물의 유전상수율은 ε=27이다(Ramos et al., 2002). 즉, 아임계수 추출 기술이란 물의 유전상수율을 유기용매인 메탄올(ε=33.6) 및 에탄올(ε=24.5)의 유전상수율과 유사하게 설정하여 기존 유기용매를 이용하여 추출하던 성분을 오직 물로만 추출할 수 있는 친환경적인 기술이다(Ko et al., 2019). 또한, 아임계수 추출 기술은 물의 온도와 압력의 조절로 유효성분을 선택적으로 추출할 수 있다. 아임계수 추출 기술은 기존의 유기용매 추출법에 사용되는 유기용매를 순수한 물로 대체하여 유기용매가 환경과 인체에 끼치는 부정적인 영향이 없으며, 기존 헥세인과 같은 유기용매를 이용하여 테르펜류를 추출하던 추출 기술보다 추출 효율이 비교적 높고 경제적이다(Cheigh et al., 2011). 이전 연구에서 세이지의 테르펜류 추출은 환류 추출 방법을 이용하여 120분의 오랜 시간 동안 추출하였다(Ollanketo et al., 2002; Radivojac et al., 2020). 아임계수 추출 기술은 고온 고압에서 추출하여 추출 공정이 30분 이내로 빠르며, 추출에 사용되는 유기용매의 양의 감소를 통한 비용 절감으로 경제적이며 산업적으로 친환경적인 추출 방법이다(Zakaria et al., 2015).
본 실험에서는 세이지의 함유된 테르펜류인 캠퍼, 보르네올, 유칼립톨 세 가지 성분의 함량을 다양한 추출 방법(아임계수 추출 기술과 용매 추출법) 및 추출 조건(아임계수 추출 온도 및 시간)에 따라 추출하고 추출물의 유효성분 함량을 분석하였다. 추출물의 함량을 비교 분석하여 아임계수 추출을 이용한 테르펜류의 최적 추출 조건을 설정하였다. 설정된 최적 추출 조건의 유효성분의 함량과 다양한 용매를 이용한 추출물의 유효성분 함량을 비교 분석하였다.
재료 및 방법
본 실험에서 사용된 세이지는 건조된 튀르키예산 세이지(Shinyoung FS Co, Gwangju, Gyronggi, Korea)를 사용했으며 수분 함량은 10.5±0.1%이다. 세이지는 분쇄 후 2 mm 크기의 메쉬로 체과하여 추출에 사용하였다. 유효성분 분석에 사용된 표준 물질은 캠퍼(≥99.0%), 보르네올(≥99.0%), 그리고 유칼립톨(≥99.0%)이며, Sigma-Aldrich (St. Louis, MO, USA)에서 구매하였다. 에탄올, 아세톤과 헥세인은 Deoksan pure Chemicals (Ansan, Gyeonggi-do, Korea)에서 구매하였다.
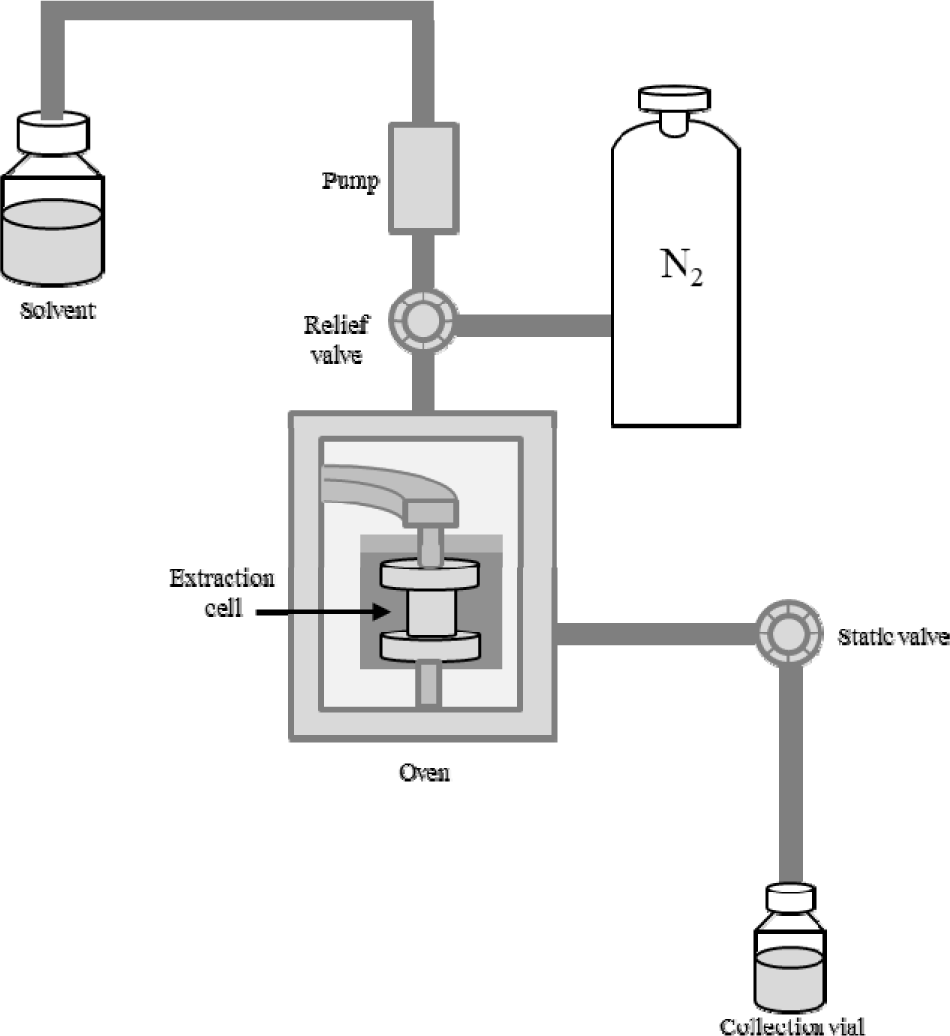
아임계수 추출(Subcritical Water Extraction, SWE)은 추출 셀이 오븐에 장착되면 장착된 셀 내부에 용매를 넣은 후 압력은 질소 가스의 주입으로 조절하며, 온도는 오븐의 히터로 조절한다. 본 실험에서 사용된 아임계수 추출기의 모식도는 Fig. 1에 나타내었으며, 아임계수 추출기기는 가속 용매 추출기(ASE 350; Dionex, Sunnyvale, CA, USA)를 사용하였다. 용매로는 1차 증류수를 사용하였다. 추출 시료와 규조토는 세이지 1 g과 규조토 2 g을 혼합하여 22 mL 크기의 스테인리스강 추출 셀에 넣고 아래에 셀룰로스 필터(Whatman, Maidstone, UK)를 장착한 후 추출을 진행하였다. 추출 조건은 110, 130, 150, 170, 190 그리고 200°C로 하였으며, 추출 시간은 5, 10 그리고 15 min으로 설정하였다. 설정된 추출온도와 시간에서 추출이 완료된 추출물은 질소가스로 1 min 동안 퍼징한 후 추출 바이알에 수집하였다. 추출이 완료된 추출물은 헥세인 22 mL로 liquid-liquid extraction을 통해 상층액을 분리하였다. 분리한 상층액을 원심분리기를 이용하여 불순물을 제거한 후, 다시 맑은 상층액을 취하여 바이알에 담아 분석하였다.
용매 추출은 침용 추출법을 사용하였다. 침용 추출은 가장 널리 사용되는 추출 방법이다. 침용 추출은 식물에서 페놀 화합물을 추출하는 데 널리 사용되며, 주로 에탄올이나 메탄올을 용매로 사용하여 추출한다(Garacoa-Vaqiero et al., 2020). 본 실험에서 세이지 침용 추출에 사용한 용매는 물, 30% 아세톤 그리고 30% 에탄올을 사용하였다(Dent et al., 2013). 유기용매 추출은 시료 1 g과 22 mL의 용매를 바이알에 담아 항온 수조에서 추출하였다. 추출 온도와 시간은 60°C와 30 min으로 추출하였다. 추출물은 헥세인 22 mL로 liquid-liquid extraction을 진행하고 상층액을 분리하여 원심분리 후 맑은 상층액을 바이알에 담아 분석하였다.
모든 추출물은 분석을 위해 syringe filter (0.45 μm, Whatman, Maidstone, UK)를 이용하여 필터링 후 가스크로마토그래피를 이용하여 분석하였다. 가스크로마토그래피는 Agilent 6890 series system (Agilent technologies, Santa Clara, CA, USA)을 사용하였으며, 검출기는 flame ionization detector (FID), 칼럼은 Agilent HP-5 (30 m, 0.25 mm, 0.25 μm)를 사용하였다. 운반가스는 He, Air 그리고 H2를 사용하였다. 가스크로마토그래피 분석 조건으로 헬륨의 유량은 20 mL/min, 산소 유량은 400 mL/min, 수소 유량은 40 mL/min으로 진행하였다. 오븐은 시작 온도인 50°C에서 2분간 유지 후 250°C까지 분당 4°C를 증가시켜 250°C에 도달 후 5분 동안 유지하였다. 총 분석 시간은 약 60분으로 진행하였으며, 인젝터와 검출기의 온도는 250°C, 분할비는 10:1, 주입 부피는 1 μL이다.
결과 및 고찰
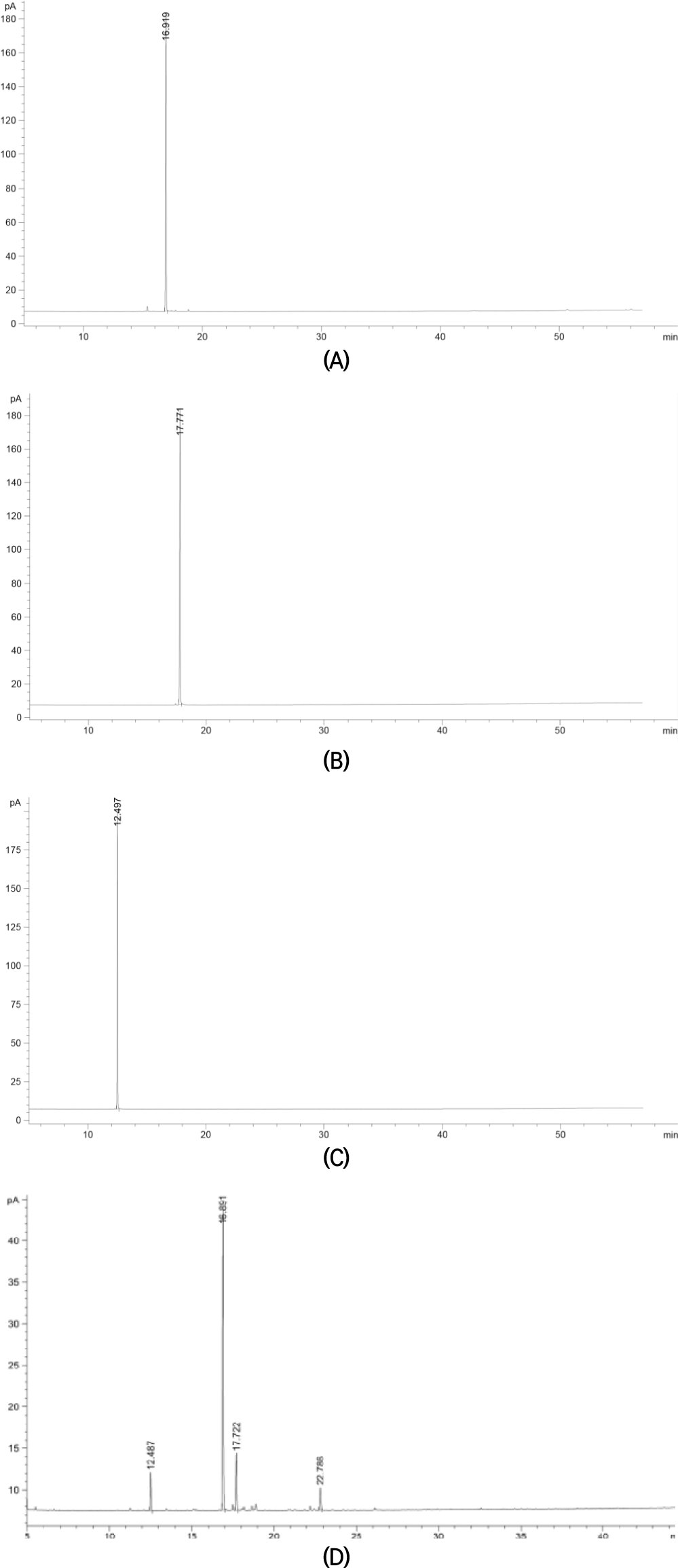
세이지 추출물의 대표적인 유효성분으로는 캠퍼, 보르네올 그리고 유칼립톨이며 정성 및 정량 분석은 가스크로마토그래피를 이용하여 분석하였다. 세 가지 화합물 모두 0.5, 0.25, 0.125, 0.0625, 0.03125 그리고 0.15625 mg/mL로 헥세인에 희석하여 검량선을 얻었으며, 표준물질의 0.5 mg/mL의 농도의 가스크로마토그래피 분석결과를 Fig. 2에 나타내었다. 세 가지 화합물의 각각의 검출시간대는 캠퍼는 16.9 min, 보르네올은 17.7 min, 그리고 유칼립톨은 12.4 min에서 검출되었다. 캠퍼, 보르네올 그리고 유칼립톨의 각각의 표준 곡선은 y=1,274.8x+3.6619, R2=1, y=1,526.5x–13.629, R2=0.999, 그리고 y=1,230.8x+0.9296, R2=0.999이다.
아임계수 추출 조건인 110, 130, 150, 170, 190, 200°C에서 5 min, 10 min, 10 min 동안 추출을 진행하여 세이지에 함유되어 있는 대표적인 테르펜류인 캠퍼, 보르네올, 유칼립톨의 각각의 아임계수 추출 조건에서의 추출 함량 변화를 확인하였다(Table 2).
캠퍼의 녹는점은 180°C로 높은 편에 속하며, 캠퍼의 구형의 가까운 구조적 특성 때문에 높은 온도에서 비교적 안정하다(Andersson et al., 1990; Kumar et al., 2003). 아임계수 추출 조건에서 추출 온도 변화에 따른 캠퍼의 함량 차이는 크게 나타나지 않았다. 따라서 캠퍼는 다른 테르펜류에 비해 비교적 높은 추출 온도인 아임계수 추출 조건에서 안정한 것으로 판단된다. 캠퍼의 경우 최적 추출 조건은 130°C, 5 min이며, 최대 함량은 2.73±0.39 mg/g이었다. 캠퍼는 110°C를 제외한 모든 온도에서 5 min의 추출 시간에서 가장 높은 함량을 나타내었다. 캠퍼는 아임계수 추출 시 짧은 시간에 추출이 더 잘 되는 경향을 나타내었다.
보르네올의 경우, 최적 추출 조건은 130°C, 5 min으로 캠퍼와 동일했으며 함량은 0.72±0.07 mg/g이었다. 보르네올은 각각의 온도 조건에서 5 min이 최적 추출 시간이었고, 15 min 추출 조건에서 가장 적은 함량을 나타내었다. 따라서, 보르네올은 아임계수 추출 조건에서 비교적 적은 추출 시간에 효과적인 경향을 나타내었다.
유칼립톨은 150°C, 5 min이 최적 추출 조건으로 함량은 0.51±0.03 mg/g이었다. 유칼립톨은 아임계수 추출 시 캠퍼와 보르네올에 비해 온도에 영향을 비교적 크게 받는 것으로 나타났다. 유칼립톨은 110°C부터 150°C까지 함량이 증가하였으며, 150°C보다 높은 온도에서는 추출 함량이 급격히 감소하였다. 이전 연구에 따르면 유칼립톨은 150°C보다 높은 온도에서 함량이 급격하게 감소하며 이는 열분해로 인한 감소로 판단된다는 연구결과와 유사하다(He et al., 2012; Jiménez-Carmona et al., 1999).
다양한 추출용매를 이용하여 전통적인 추출방법인 침용 추출 방법을 이용하여 세이지에 함유되어 있는 테르펜류의 추출경향을 비교하였다(Table 3). 추출용매는 물, 30% 에탄올, 30% 아세톤을 이용하였으며 모두 60°C, 30 min 동안 추출하였다. 물을 용매로 한 추출물을 가스크로마토그래피로 분석한 결과, 캠퍼, 보르네올, 그리고 유칼립톨의 함량은 각각 0.31±0.01 mg/g, 0.07±0.03 mg/g 나타냈고, 유칼립톨은 검출이 되지 않았다. 유칼립톨은 아임계수 추출조건에서도 가장 비극성이 높은 비교적 높은 온도인 150°C에서 최적 추출되는 경향을 나타낸 것과 같이 세이지에 함유되어 있는 테르펜류 중에서도 유칼립톨은 가장 비극성이 높은 성분이기 때문에 극성의 물의 용매에서는 검출이 되지 않은 것으로 판단된다. 30% 에탄올을 용매로 한 추출물의 경우 캠퍼는 1.88±0.35 mg/g, 보르네올은 0.35±0.20 mg/g 그리고 유칼립톨은 0.34±0.04 mg/g의 함량을 보였다. 30% 아세톤 추출물의 성분 함량은 캠퍼는 1.95±0.15 mg/g, 보르네올은 0.34±0.02 mg/g 그리고 유칼립톨의 경우 0.35±0.04 mg/g이었다. 30% 에탄올과 30% 아세톤의 용매를 사용하여 추출한 추출물의 각각의 테르펜류의 유효성분의 함량은 크게 차이가 없는 것으로 나타났다.
최적 추출 조건의 아임계수 추출물의 캠퍼, 보르네올 그리고 유칼립톨의 함량과 전통적인 침용 추출방법을 이용한 추출물의 테르펜류의 함량을 비교하였다(Table 3). 캠퍼는 아임계수 추출 시 최적 조건은 130°C, 5 min으로 함량은 2.73±0.39 mg/g으로 동일한 용매로 열수 추출한 추출물과 비교 결과, 0.31±0.01 mg/g으로 같은 용매지만 8배 이상의 차이를 보였다. 또한 세이지 추출 시 사용되는 30% 에탄올과, 30% 아세톤의 경우 각각 1.88±0.35와 1.95±0.15 mg/g의 함량을 보였다. 캠퍼는 아임계수 추출이 기존 유기용매의 추출보다 약 1.4배 높은 함량을 보였다. 보르네올의 경우, 아임계수 추출의 최적 조건과 함량은 각각 130°C, 5 min과 0.72±0.07 mg/g이다. 보르네올의 열수 추출의 함량은 0.07±0.03 mg/g이며, 30% 에탄올과 30% 아세톤의 경우 함량은 0.35±0.20 mg/g와 0.34±0.02 mg/g이다. 보르네올의 함량은 아임계수 추출이 유기용매 추출보다 약 2배 이상 높았으며, 열수 추출보다는 약 10배가 높은 것을 확인할 수 있었다. 유칼립톨의 아임계수 추출 최적 조건과 함량은 150°C 5 min과 0.51±0.03 mg/g이다. 열수 추출물은 검출되지 않았으며, 30% 에탄올은 0.34±0.04 mg/g의 함량을 보였으며, 30% 아세톤은 0.35±0.04 mg/g의 함량을 보였다. 아임계수 추출이 1.4배 이상 높은 함량을 보였으며, 이는 유칼립톨이 쉽게 휘발되는 성분으로 유기용매를 이용한 침용 추출법에서는 오랜 추출 시간에 의해 휘발된 것으로 판단된다.
요 약
본 실험에서는 아임계수 추출 기술을 이용하여 세이지의 함유된 테르펜류인 캠퍼, 보르네올 그리고 유칼립톨을 추출하였으며, 아임계수 추출과 다양한 용매를 이용한 침용 추출방법 추출물의 테르펜류의 함량을 비교 분석하였다. 아임계수 추출 기술을 이용하여 추출 시 캠퍼와 보르네올은 비교적 낮은 온도인 130°C와 짧은 시간인 5 min에서 가장 높은 함량을 보였으나, 두 성분 모두 비교적 온도에 안정적인 테르펜류로 온도에 따른 함량의 차이는 크게 나타나지 않았다. 유칼립톨의 경우는 캠퍼와 보르네올 보다 높은 온도인 150°C에서 가장 높은 함량을 보였으며 170°C 이상의 온도에서는 함량이 급격히 줄어드는 것을 볼 수 있었다. 아임계수 추출 기술을 이용한 추출물과 다양한 용매를 이용한 추출물의 분석 결과 아임계수 추출 기술을 활용한 추출물이 세 성분 모두 더 높은 함량을 보였다. 이는 아임계수 추출 기술을 이용한 추출이 기존 유기용매를 이용한 추출보다 짧은 시간에 더 높은 효율의 추출이 가능한 것을 의미하며, 아임계수 추출 기술을 이용하여 기존 전통적인 추출방법을 대체하여 테르펜류와 같은 유효성분을 친환경적으로 추출하는데 응용할 수 있는 가능성을 나타낸다.