서 론
2050년까지 세계 인구는 약 72억 명에서 약 95억 명으로 약 23억 명이 증가할 것으로 예상되며, 이에 따라 식량 생산량은 약 70% 증가해야 한다(Godfray et al., 2010). 단백질은 사람에게 필요한 필수 영양소이며, 그 동안은 육류, 유제품, 난류 등 동물성 단백질 식품으로 단백질의 대부분을 섭취해왔다. 동물성 단백질은 필수 아미노산이 풍부하고, 적은 양으로도 영양소와 많은 에너지를 얻을 수 있으나, 연구에 따르면 기존의 축산업은 전 세계적으로 환경, 식량 위기 및 동물 복지에 부정적인 영향을 미치는 것으로 평가되고 있다(Bryant & Sanctorum, 2021; Michel et al., 2021). 환경 측면에서는 축산업이 기후변화를 심화 시키는 온실 가스의 14.5%를 배출하는 것으로 추정되고(Gerber et al., 2013), 축산업을 위한 토지 사용은 삼림 벌채를 초래하여 생물 다양성을 악화시킨다(Garcia et al., 2017). 또한 동물 복지에 대한 관심이 높아지고 있는 가운데 전 세계 농장 동물의 90% 이상이 공장식 조건에서 잠재적인 고통 속에 살고 있는 것으로 추정된다. 이러한 중요한 문제점들을 해결하기 위한 대안으로 대체 단백질 및 대체 육류와 같은 새로운 친환경적인 식량 공급원이 관심을 끌고 있다(Tilman et al., 2011; Lee et al., 2020; Tso et al., 2021). 현재 가장 대표적인 대체 단백질 주원료는 대두, 완두, 녹두와 같은 식물성 단백질이 있으며, 미세조류, 곤충 역시 활용 가능한 소재로 알려져 있다(Asgar et al., 2010; Kim et al., 2021). 이러한 연구 흐름에 따라 다양한 대체 단백질 소재가 등장하고 있는데 이 중 미세조류는 자원 활용성과 지속가능성의 장점 있어 대체 단백질 식량원으로서 미래 가치가 높다.
미세조류는 광합성 대사를 통해 성장하는 단세포 미생물로써 이산화탄소를 탄소원으로 이용하여 탄수화물, 단백질, 지질을 합성할 수 있는 식물 바이오매스 자원이다(Jeon et al., 2008; Joo et al., 2015). 현재 미세조류를 이용한 상업적 응용 분야는 건강 기능성 식품, 천연 색소, 사료, 의약품, 화장품, 비료, 생물학적 정화 및 에너지 생산에 이르기까지 다양한 분야로 확대되고 있어 생산량 또한 계속 증가하고 있다(Li et al., 2008; Rizwan et al., 2018). 그럼에도 불구하고 미세조류 수확은 아직 산업적 규모로 확장되고 있지 않다(Khoo et al., 2020). 미세조류의 고부가가치 활용을 가로막는 가장 큰 장애물은 고도로 희석된 용액에서 작은 미세조류 세포를 효과적으로 회수하는 것이다(Vandamme et al., 2011; Koley et al., 2017).
미세조류 수확 방법은 미세조류 종의 특성, 배양액의 밀도, 배양 배지의 재사용 여부, 최종 제품의 사양에 따라 크게 달라진다(Uduman et al., 2010; Amaro et al., 2011; Rawat et al., 2011). 그러나 미세조류 세포는 일반적으로 3~30 µm로 매우 작고, 배양액 농도가 0.2~1 g/L으로 낮고, 세포의 음전하 때문에 미세조류 바이오매스 회수가 매우 어렵다(Molina Grima et al., 2003; Vandamme et al., 2013; Amini et al., 2016; Leite et al., 2019). 현재 미세조류 수확에는 원심분리(Rodolfi et al., 2003), 화학적 응집(Vandamme et al., 2010), 여과(Danquah et al., 2009), 부유(Uduman et al., 2010), 초음파 처리(Bosma et al., 2003) 등 많은 분리 공정이 연구되어왔다. 원심분리는 미세조류 수확에서 널리 사용되는 대표적인 방법이지만 에너지 사용이 크고 대규모 수확에는 적용하기 어렵다(Fasaei et al., 2018). 또한 여과는 수확 과정에서 필터 막힘 현상이 빈번히 일어나 유지 관리에 문제점이 있다(Zenouzi et al., 2013). 대안으로 화학 응집제 사용이 있으나 응집제가 과잉으로 사용되면 바이오매스에 직접적 또는 간접적으로 영향을 미치며 환경 오염의 문제도 있다(Morales et al., 1985; Baierle et al., 2015). 이러한 문제점들의 미세조류 수확에 있어 전기 응집 처리 방법이 좋은 대안이 될 수 있다(Barros et al., 2015). 전기 처리 방법은 전극과 용액의 계면에서 직접적인 전자 전달이 이루어지는 전극 반응과 전극 반응 생성물이 현탁액 중의 성분과 반응하는 2차 반응으로 구분할 수 있으며, 이를 이용한 전기 투석, 응집, 부상분리, 유기물의 직접 및 간접 산화, 중금속의 회수 등에 이용되고 있다(Vandamme et al., 2011). 전기응집은 전기화학적 반응을 이용하여 수중의 미세입자를 응집·제거하는 기술로, 미세조류 수확에도 효과적으로 적용된다. 양극에서 금속 이온이 용출되고 이들이 수중 수산화물 형태로 전환됨으로써 미세조류 세포 표면의 음전하를 중화하거나 전하 균형을 변동시켜 세포 간 응집을 유도하는 전기화학적 수확 방식이다. 이어서 음극에서는 수소 발생 반응이 동반되어 미세한 기포가 생성되며, 이는 응집된 세포 플록을 부상시켜 분리 효율을 향상시키는 데 기여한다. 이러한 전기응집–부상 메커니즘은 전류밀도, 전극 재질, 전극 간격, pH 등의 운전 인자에 의해 크게 좌우되며, 최적화된 조건에서는 화학적 응집제 투입 없이도 높은 수확 효율을 달성할 수 있다(Vandamme et al., 2011; Vandamme et al., 2013; Barros et al., 2015). 전극을 이용하는 전기 응집의 경우 기존의 화학적 처리 방법과 달리 독성물질의 간접을 배제할 수 있으며, 높은 회수율과 처리시간이 짧은 운전 특성을 가지고 있어 미세조류 수확에 응용가능성이 높은 것으로 평가된다. 또한 전극 재료는 철과 같은 생체 원소일 수 있으며, 기계적 장치는 전압 및 전류에 의해 쉽게 제어할 수 있다는 장점이 있다. 2010년부터 2020년 사이에 미세조류의 효과적인 수확 방법으로써 전기 응집을 이용하는 여러 연구가 발표되었다. 연구에서 사용된 미세조류 종은 Chlorella 종(Lal & Das, 2016; Fayad et al., 2017; Luo et al., 2017; Rahmani et al., 2017; Wong et al., 2017; Castellanos-Estupinan et al., 2018), Botryococcus 종(Xu et al., 2010), Desmodesmus 종(Baierle et al., 2015), Dunaliella 종(Zenouzi et al., 2013; Xiong et al., 2015; Liu et al., 2017), Microcystis 종(Gao et al., 2010), Nannochloropsis 종(Matos et al., 2013), Scenedesmus 종(Valero et al., 2015), Tetraselmis 종(Lee et al., 2013) 등이 있다. 그러나 연구는 주로 Chlorella 종과 Dunaliella 종에 대한 것이 많아 보다 다양한 미세조류 종에 대한 연구가 이루어져야 하며, 다양한 조건에서의 처리를 통해 최적 조건 확립이 필요하다. 또한 Scenedesmus 종의 전기 응집을 연구한 Valero et al. (2015)의 경우 바이오 디젤 생산을 위한 전기응집 수확으로 공정의 효율성에 영향을 미칠 수 있는 요인으로 전압, 전극 간 거리, 배양 용기의 높이만을 비교 평가하였다. 전기 응집 수확은 전극의 종류, 전류 밀도 등 조건에 따라 영향을 받으며 효과적인 수확을 위해서는 다양한 처리 조건에 대한 비교 연구 및 최적 처리 조건의 도출이 필요하다. 따라서 본 연구에서는 단백질 함량이 높은 Scenedesmus obliquus의 회수 수확 증대를 목적으로 교반 여부, 교반 속도, 초기 pH, 전극 재질, 전류 밀도, 전류 세기, 전극 간격, 전극 배치가 미세조류 수확에 미치는 영향을 연구하고, 미세조류를 수확하기 위한 최적 조건을 확립하고자 한다. 이를 통해 전기 응집 기술이 미세조류의 수확에 유망하고 실행가능한 공정임을 증명하고자 한다.
재료 및 방법
본 실험에 사용한 미세조류 Scenedesmus obliquus(AG10047)는 생물자원센터(Korean Collection for Type Cultures, KCTC)에서 분양 받았다. 배양 배지는 BG 11를 제조하여 고압 멸균기(AC-100, Hanyang Science Lab Co., Ltd, Korea)를 이용해 121℃에서 15분간 멸균하여 실험에 사용하였다. BG 11 배지는 KCTC media No. 1645으로 조성은 Table 1과 같다. 종균은 250 mL 삼각 플라스크에 100 mL 배지와 분양 받은 균주 10 mL를 넣고 온도 25℃, 3,000 Lux 광도로 24시간 빛 공급, 교반 속도 120 rpm, 공기 주입은 하지 않는 조건, 초기 접종 농도 1.0×106 cells/mL으로 수행되었다. 본 연구에 사용된 S. obliquus는 담수성 녹조류로, 세포 크기가 약 6∼12 µm에 이르며 2~4개의 세포가 선형 군체를 이루는 형태적 특징을 가진다. 본 균주는 성장속도가 빠르고 질소원 조성에 따라 단백질 및 지질 축적 비율이 유연하게 변하는 종으로 알려져 있으며, 일반적으로 건조중량 대비 단백질 함량이 약 45∼55%, 지질 함량이 15∼25% 수준으로 보고된다. 이러한 높은 단백질 함량은 세포 표면에 존재하는 아미노산 잔기의 노출도를 증가시켜 세포벽의 음전하 분포에 영향을 미치며, 이는 전기응집 시 전극 용출 금속 이온과의 정전기적 상호작용을 매개하여 응집 효율을 조절할 수 있다. 특히 S. obliquus는 상대적으로 두꺼운 세포벽과 풍부한 다당·단백질 복합체로 구성된 외층을 가지고 있어, 단순 교반이나 침전으로는 회수가 어렵지만, 전기응집 공정에서는 이러한 표면 특성이 결합할 수 있는 반응 부위를 제공함으로써 오히려 효율적인 세포 수확을 촉진할 수 있다(Valero et al., 2015). 본 실험에 앞서 선행 연구를 통해 S. obliquus의 최적 배양 조건을 확립하였고, 구체적인 배양 조건은 Table 2와 같다. 이후 최적 배양 조건에 따라 7일간 배양한 후 실험에 사용하였다.
본 실험에서 사용한 장치는 전원공급장치(SPS-H3010, GVDA, China), 자석 교반기(PC-420D, Corning), 전극판을 사용하였다. 반응 용기 내부에는 산화극과 환원극 전극판을 수직 방향으로 배열했으며, 시료의 완전 혼합을 위하여 마그네틱 바를 투입하여 교반이 일어나도록 하여 시료의 농도 불균형이 발생하지 않도록 하였다. 실험에 사용한 전극은 산화극의 경우 알루미늄 재질을 사용하였으며, 환원극은 스테인리스 재질을 사용하였다. 전극은 폭 45 mm, 길이 150 mm, 두께 0.5 mm으로 전극판을 반응기에 꽂아 사용하였다. 전극판은 실험 전 10% 질산용액에 12시간 침적시킨 후 증류수로 여러 차례 세척하여 건조한 후 사용하였다. 본 실험은 상온(25℃±3)에서 진행하였으며, 초기 pH는 0.5N NaOH와 0.5N HCl을 이용하여 조절하였다. 미세조류의 수확을 위한 전기 응집 실험의 구체적인 조건은 Table 3과 같다.
미세조류의 응집 효율을 확인하기 위한 지표로 OD (optical density)를 측정하였으며, OD값은 분광 광도계(SpectraMax ABS Plus, Molecular Devices, San Jose, CA, USA)를 이용하여 측정하였다. 미세조류의 응집이 진행되면서 응집된 미세조류는 발생된 미세 기포에 의해 부상하게 된다. 따라서 응집 효율 측정은 먼저 응집 전 배양액의 OD 값을 측정하고, 응집 반응이 끝난 직후 부상된 미세조류 하부 5 cm 지점을 채취하여 OD 값을 측정함으로써 응집 효율을 계산하였다. OD 값 지표가 실제 수확된 미세조류의 건조 중량과 상관성을 갖는지를 검증하기 위해 추가 분석을 수행하였다. 분석 결과, 전기응집 후 상등액 제거 후 남은 침전물의 건조중량을 측정한 결과와 OD 값 기반 계산식에 기반한 회수 효율 간에는 유의한 양의 상관관계(r=0.94, p<0.01) 가 확인되어 본 연구의 계산식이 실제 바이오매스 수확량을 잘 반영함을 입증하였다. 아래의 식에서 A는 Final OD이고, B는 Initial OD이다. 모든 실험은 동일 조건에서 5회 반복 수행하였으며, 각 조건의 결과는 반복 실험값의 평균으로 산출하여 제시하였다. 반복 간 편차는 전체 측정값 대비 ±1.5% 이내로 나타나, 그래프에서는 표준편차를 생략하였다.
결과 및 고찰
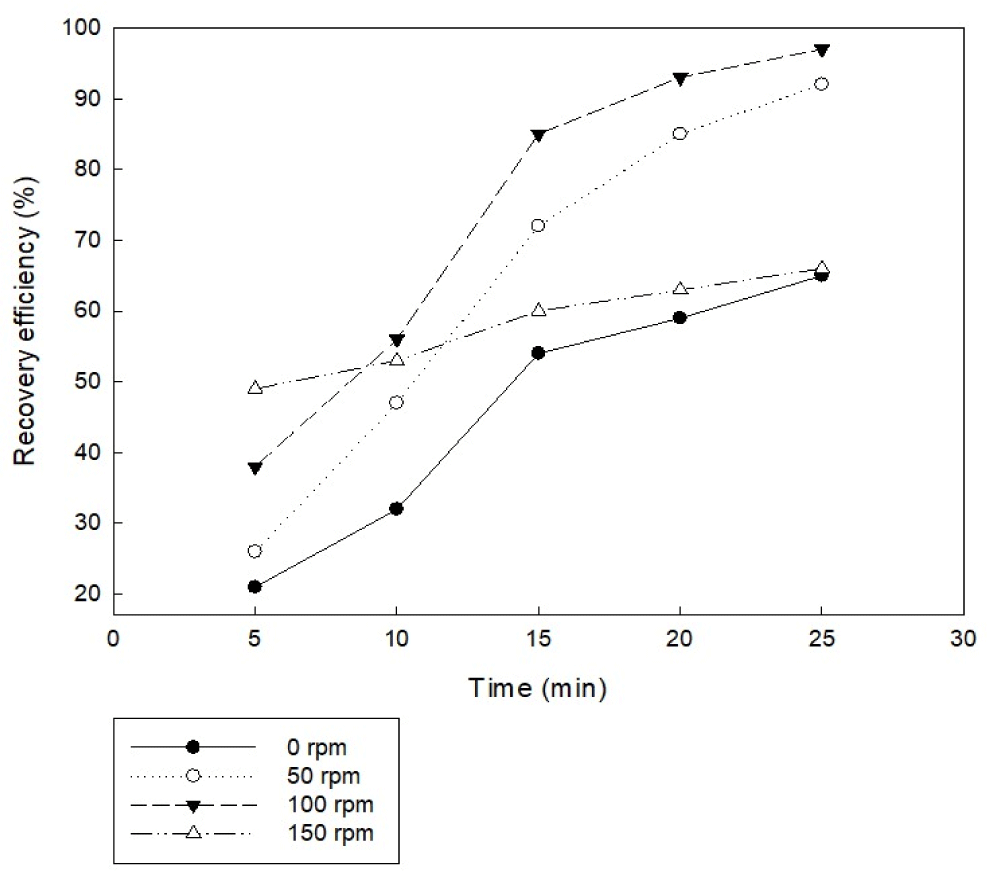
교반은 배양액의 흐름을 원활하게 만들어 주어 양이온 전극에서 용출된 금속 이온과 음이온 전극에서 발생된 미세 기포의 접촉성을 향상시켜 단시간 내에 효과적으로 수면에서 수확이 가능하여 응집에 긍정적인 영향을 미친다(Mollah et al., 2004). 실험 조건은 전극 면적 67.5 cm2의 알루미늄 전극을 이용하였고, pH 5, 전류 밀도 20 A/m2, 전류 세기 0.2 A, 전극 간격 5 cm으로 설정하였고, 교반을 하지 않은 조건과 100 rpm의 속도로 교반을 실시한 조건을 비교하였다. 교반 유무에 따른 응집 효율을 평가한 결과, Fig. 1과 같이 100 rpm의 속도로 교반을 실시한 조건에서는 20분 반응 후 90% 이상의 응집 효율을 나타내었다. 반면 교반을 하지 않는 실험군은 미세조류 일부가 장시간에 걸쳐 침전되고 25분 반응 후에도 65% 이하의 응집 효율을 보였다. 또한 미세 기포에 포집된 나머지 미세조류는 부유하고 있는 것을 확인할 수 있었다. 이러한 결과는 Pandey et al. (2020)와 일치한다. 따라서 전기 응집에 의한 미세조류 수확에 있어서 교반을 실시하는 것이 바람직하다고 판단되었다.
이에 따라 교반 속도에 따른 미세조류 응집 효율 평가를 진행하였다. 기본적인 실험 조건은 전극 면적 67.5 cm2의 알루미늄 전극을 이용하였고, pH 5, 전류 밀도 20 A/m2, 전류 세기 0.2 A, 전극 간격 5 cm으로 하여 실험을 진행하였다. 교반 속도는 50, 100, 150 rpm 범위로 설정하여 교반 속도에 따른 최적 수확 효율을 확인하였다. 실험 결과, Fig. 1과 같이 50 rpm 조건에서는 5분 반응 후 25%의 응집 효율에서 20분 반응 후 90%의 응집 효율을 보였다. 100 rpm 조건에서는 5분 반응 후 38%의 응집 효율에서 20분 반응 후 90% 이상의 응집 효율을 나타냈다. 그러나 150 rpm은 5분 반응 시 49%의 응집 효율로 반응 초기 높은 응집 효율을 보였으나 25분 반응 후에도 목표하는 95%의 응집 효율에 도달하지 못하였다. 이것은 교반 속도가 증가할수록 양이온 전극에서 용출된 금속 이온, 음이온 전극에서 발생된 미세 기포와 미세조류의 접촉 확률이 증가하여 미세조류 회수율이 높아지는 것으로 설명할 수 있다. 그러나 교반 속도가 일정 임계치 이상으로 높아지면 높은 전단력에 의해 미세조류 응집이 분해되어 회수 효율이 다시 떨어지게 된다(Vandamme et al., 2011). 이러한 결과를 바탕으로 전기 응집 반응에서 100 rpm 보다 높은 과도한 교반 속도는 오히려 미세조류 응집에 부정적인 영향을 끼쳐 응집 효율을 저해하는 것으로 확인되었다. 따라서 전기 응집에 의한 미세조류 수확에 있어서 최적의 교반 속도는 100 rpm으로 확인하였으며, 최적의 교반 속도로 설정 시 매우 효과적으로 단시간 내 전기 응집이 가능할 것으로 판단된다.
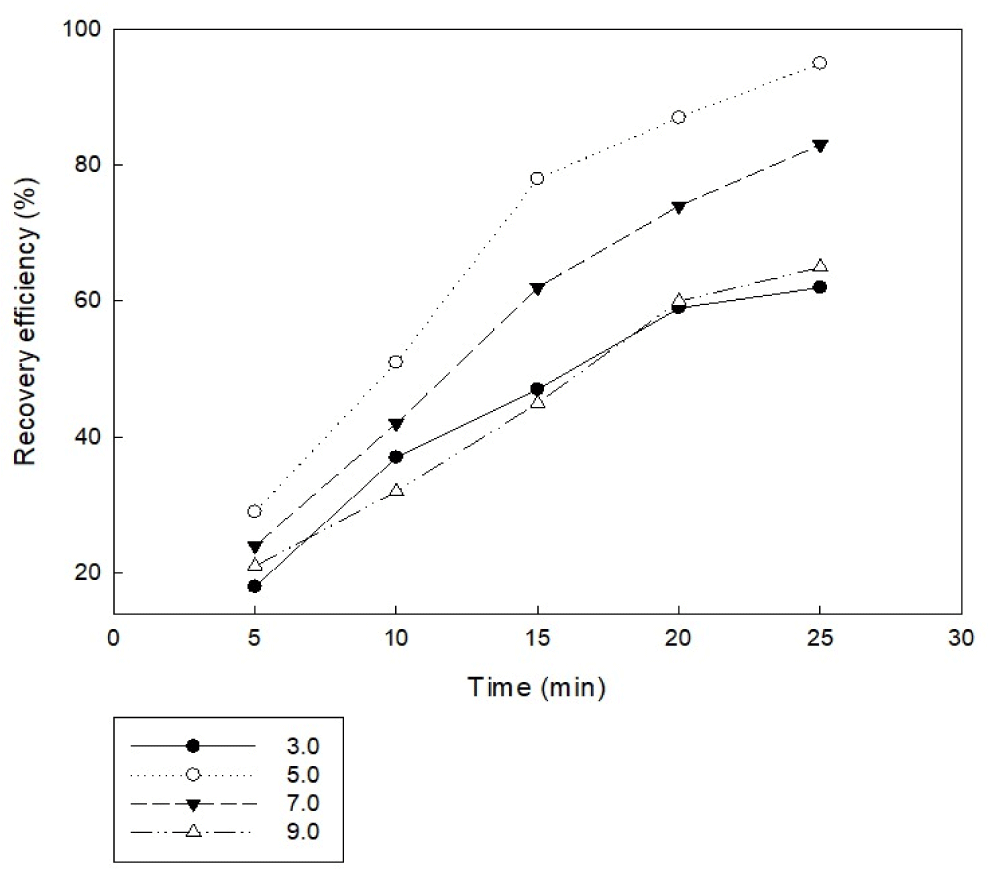
전기 응집 시 pH는 금속수산화물의 용해도 및 전류 효율에 영향을 미치기 때문에 전기 응집 반응에서 pH는 중요한 인자 중 하나이다. 일반적으로 알루미늄의 전류 효율은 산성 또는 염기성 상태에서 더 높다. 초기 pH가 미세조류 전기 응집에 미치는 영향을 알아보기 위해 전극 간격 5 cm, 전류 밀도 20 A/m2, 전류 세기 0.2 A, 교반 속도 100 rpm, 전극 면적 67.5 cm2의 알루미늄 전극을 사용하는 조건으로 초기 pH는 3.0, 5.0, 7.0, 9.0으로 설정하여 진행하였다. 실험 결과, Fig. 2와 같이 초기 pH를 3.0으로 설정한 조건에서는 25분 반응 후에도 목표하는 95%의 응집 효율에 도달하지 못하였다. 초기 pH를 5.0으로 설정한 조건에서는 25분 반응 후에 95% 이상의 응집 효율을 보였다. 초기 pH를 7.0과 9.0로 설정한 조건에서는 pH 3.0과 동일하게 25분 반응 후에도 목표하는 95%의 응집 효율에 도달하지 못하였다. 초기 pH에 따라 응집 효율이 다르게 나타나는 이유는 수중의 pH에 따라 알루미늄의 형태가 각각 다르게 나타났기 때문이다. pH 5에서는 Al(OH)4–를 제외한 모든 성분이 유사한 몰분율로 공존하여 전기 응집에 기여한 것으로 판단되었다. 반면에 pH 9일 때는 알루미늄의 형태가 Al(OH)4-의 형태로 존재하고 동시에 알루미늄의 음전하가 표면에 음전하를 띄는 미세조류와 반발하여 응집 효율이 낮게 나타난 것으로 판단된다. 따라서 미세조류 배양액의 초기 pH에 의한 미세조류 수확에 있어서 초기 pH 5.0 조건으로 실시하는 것이 바람직하다고 판단된다.
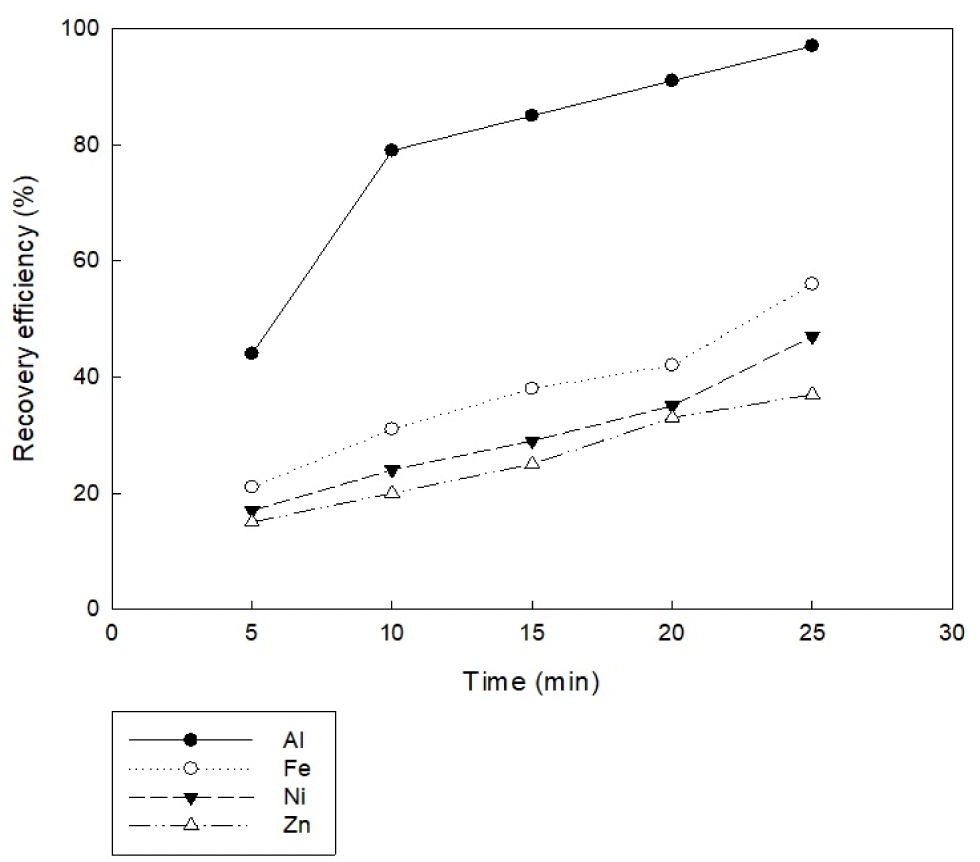
미세조류 전기 응집에 관한 문헌에서는 전극 재질이 공정 효율에 중요한 역할을 하는 것으로 알려져 있다. 전기 응집에 사용되는 전극은 양극과 음극을 동일한 재질로 할 수도 있고, 서로 다른 재질로 설정할 수도 있다. 주로 양극은 알루미늄, 철, 니켈, 아연, 구리 등이 주로 사용되며 이들 금속원자는 미세조류 배양액 속에서 용해되어 금속 수산화물을 형성하여 미세조류를 흡착시키는 동시에 발생되는 미세 기포와 함께 상승하면서 미세조류를 부상시키게 된다. 본 연구에서는 실험 조건으로 미세조류 배양액 초기 pH 5, 전극 간격 5 cm, 교반 속도 100 rpm, 전류 밀도 20 A/m2, 전류 세기 0.2 A, 전극 면적 67.5 cm2을 사용하는 조건으로 전극 재질은 알루미늄 전극, 철 전극, 니켈 전극, 아연 전극으로 구분하여 진행하였다. 실험 결과, Fig. 3과 같이 알루미늄 전극을 제외한 나머지 전극은 25분 반응 후에도 목표하는 95%의 응집 효율에 도달하지 못하였다. 모든 전기 응집 시간 값에 대해 알루미늄 전극의 회수율이 압도적으로 높았다. 알루미늄 전극을 사용하면 동일한 전류 밀도에서 철, 니켈, 아연 전극을 사용하는 것보다 회수율이 훨씬 더 높았다. 이는 Baierle et al. (2015), Gao et al. (2010), Pandey et al. (2020) 선행연구에서도 알루미늄 전극을 사용하는 것이 회수율이 가장 높았던 것과 유사한 결과이다. 따라서 전기 응집을 이용한 미세조류 수확에 있어서 알루미늄 전극을 사용하는 것이 효과적임을 입증하였다.
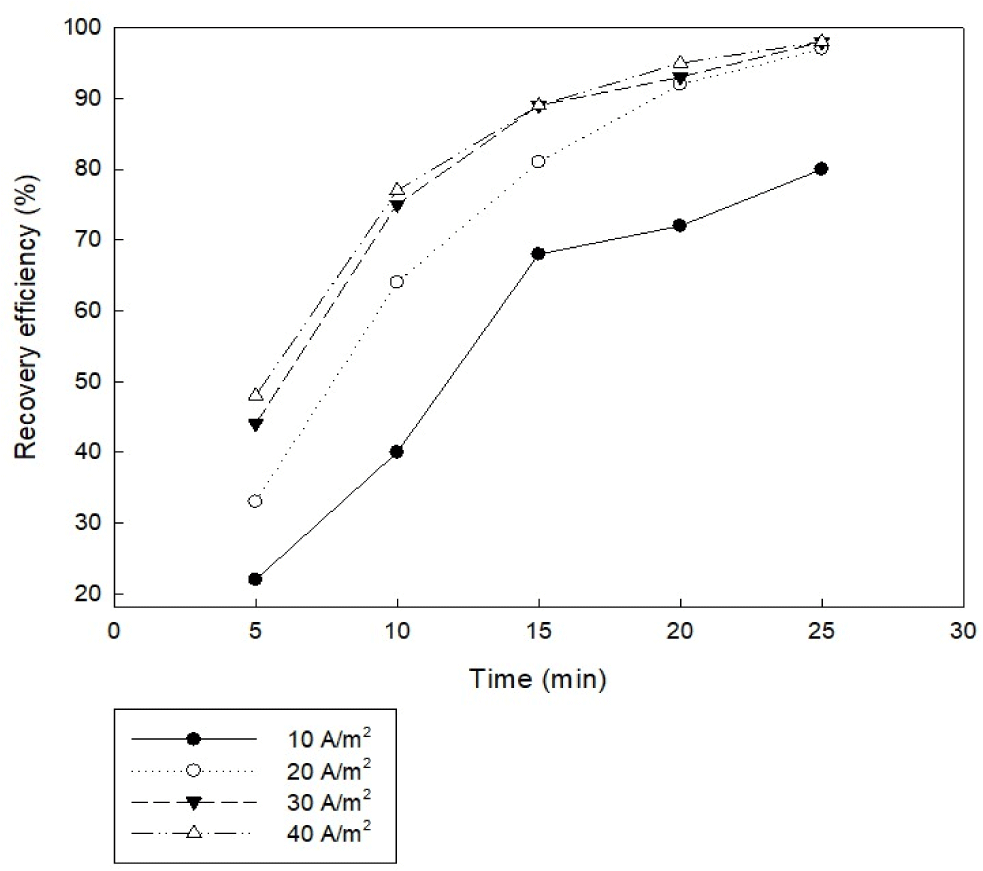
모든 전해 수확 공정에서 전류 밀도는 효율성뿐만 아니라 전력 소비 및 미세 기포 밀도 등을 좌우하는 중요한 매개변수이다(Kim et al., 2012). 전류 밀도는 전기 응집에 의하여 용출되는 금속의 양과 관련이 있으며, 전류 밀도가 커질수록 용출하는 금속 이온의 양이 비례적으로 증가하게 된다. 결과적으로 미세조류를 응집시킬 수 있는 금속 수산화물의 양도 많이 지기 때문에 응집 효율이 증가하기 된다. 그러나 전류 밀도가 높아질수록 전력 소모량이 증가하므로 경제성을 고려하면 적절한 수준의 전류 밀도를 선정할 필요가 있다. 본 연구에서는 실험 조건으로 미세조류 배양액 초기 pH 5, 전극 간격 5 cm, 교반 속도 100 rpm, 전류 세기 0.2 A, 전극 면적 67.5 cm2, 알루미늄 전극을 사용하는 조건으로 전류 밀도는 10, 20, 30, 40 A/m2 으로 설정하여 실험을 진행하였다. 실험 결과, Fig. 4와 같이 10 A/m2 전류 밀도로 실험한 경우 25분 반응 후에도 목표하는 95%의 응집 효율에 도달하지 못하였다. 나머지 20, 30, 40 A/m2 전류밀도에서는 전류밀도가 높을수록 수확 효율이 높은 경향을 보였으나 20분 반응 후에 거의 유사한 결과값을 보이고, 25분 반응 후 모두 95% 이상의 응집 효율을 나타냈다. 따라서 전기 응집을 이용한 미세조류 수확에 있어서 20 A/m2 전류밀도로 설정하는 것이 적당한 것으로 판단된다. 일반적으로 하폐수 처리 목적으로 미세조류를 전기 응집하는 경우 긴 시간 동안 운전하기 위해 전류 밀도는 20~25 A/m2가 적당하다고 알려져 있다(Chen et al., 2000).
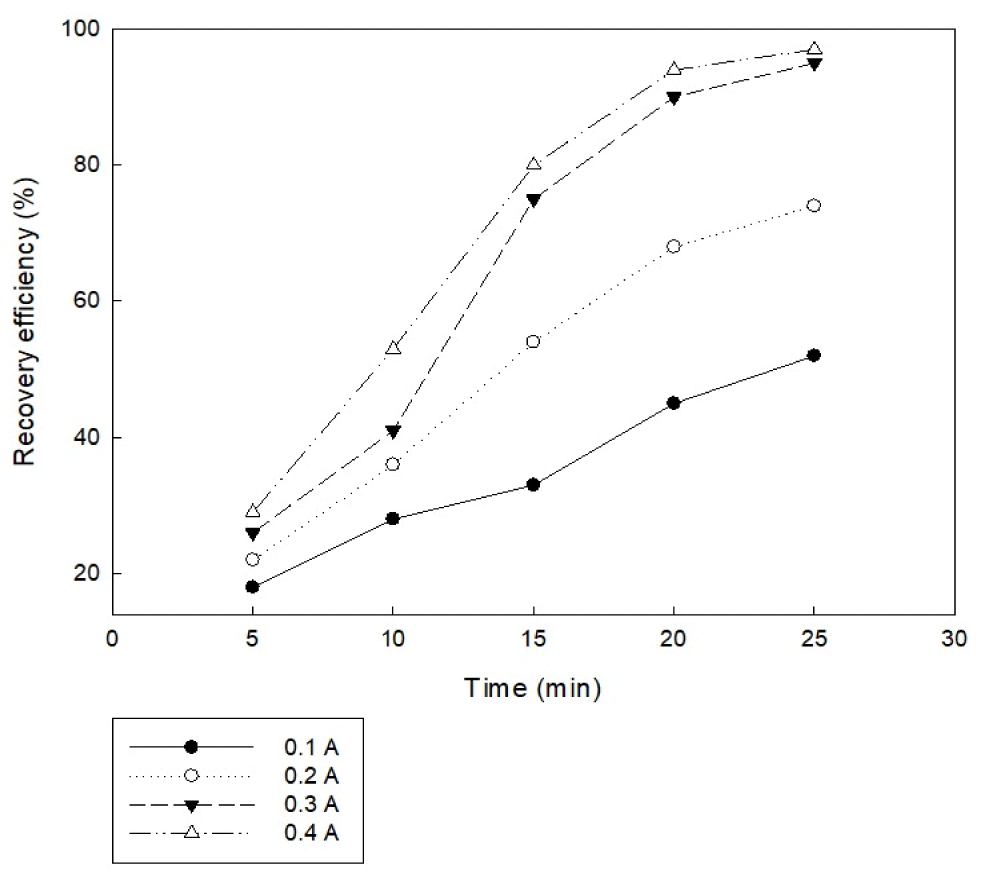
전류가 커질수록 용출 가능한 금속 이온의 양이 증가하고, 결과적으로 미세조류를 응집할 수 있는 금속 수산화물의 양도 많아지기 때문에 응집 효율이 증가하게 된다. 그러나 전류가 높을수록 무조건적으로 전기 응집 효율에 긍정적인 것만은 아니므로 적절한 전류 세기를 유지해야 한다. 전류는 극 간격이 좁을수록 전기 저항이 낮아 전압이 낮게 유지되고, 동일한 전압에서 전류를 높일수록 응집 효율이 증가하여 미세조류 응집에 대한 전력 소모가 감소한다. 본 연구에서는 실험 조건으로 미세조류 배양액 초기 pH 5, 전극 간격 5 cm, 교반 속도 100 rpm, 전류 밀도 20 A/m2, 전극 면적 67.5 cm2, 알루미늄 전극을 사용하는 조건으로 전류 세기 0.1, 0.2, 0.3, 0.4 A으로 설정하여 실험을 진행하였다. 실험 결과, Fig. 5와 같이 전류세기를 높일수록 회수율이 높아짐을 알 수 있다. 그러나 전류 세기 0.3 A와 0.4 A 모두 20분 반응 후 90% 이상의 회수율을 나타냈다. 따라서 전기 응집을 이용한 미세조류 수확에 있어서 0.3 A 전류 세기로 설정하는 것이 적당한 것으로 전망된다.
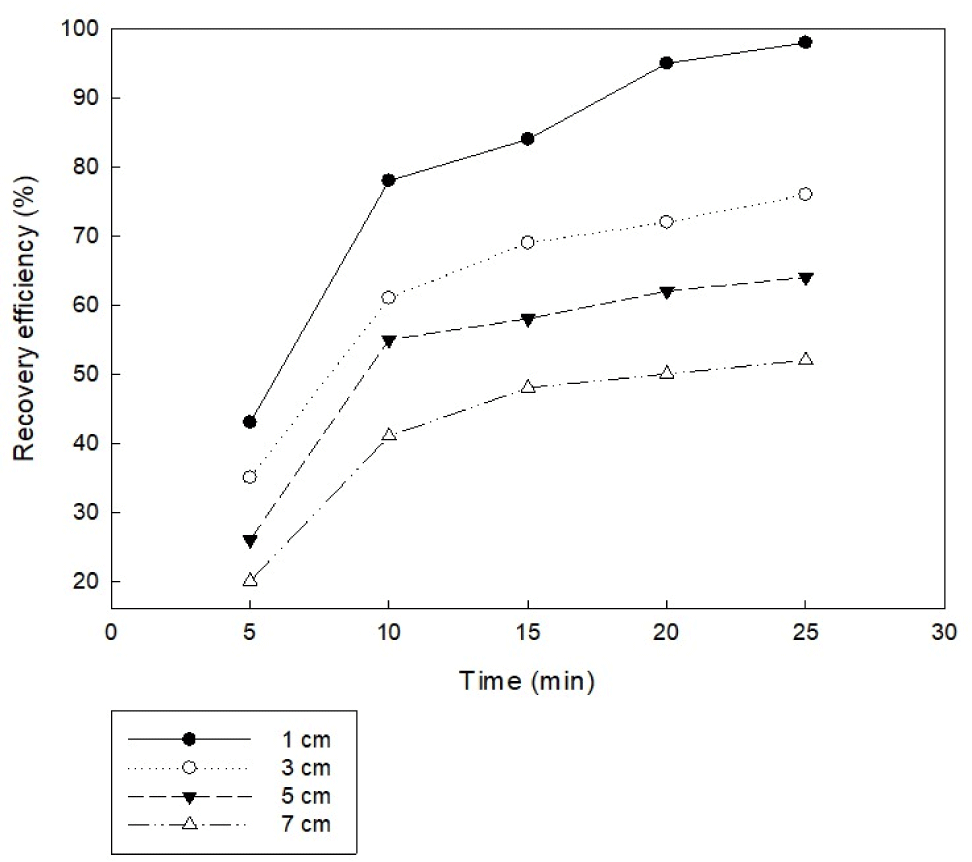
전극 간의 간격이 달라짐에 따라 전기 저항이 달라져 응집 효율에 차이가 생긴다. 일반적으로 전극 간의 간격은 전기 저항과 비례관계에 있으며, 전극 간의 거리가 가까울수록 미세조류의 응집 효율이 높다. 이는 전극 간의 거리 단축으로 인한 전기 저항이 작아져 양극에서 용출되는 금속 이온과 빠르게 반응하여 금속 수산화물을 빠르게 형성하기 때문이다. 전극 간격이 넓은 경우 전극 사이의 전력이 많이 소모되게 된다. 또한 전극 간격이 좁은 경우 전기 반응에 의해 생성된 미세조류 응집 덩어리가 전류 흐름을 방해하여 응집에 저해가 될 수 있다. 본 연구에서는 실험 조건으로 미세조류 배양액 초기 pH 5, 교반 속도 100 rpm, 전류 밀도 20 A/m2, 전류 세기 0.2 A, 전극 면적 67.5 cm2, 알루미늄 전극을 사용하는 조건으로 전극 간 간격은 1, 3, 5, 7 cm으로 설정하여 실험을 진행하였다. 실험 결과, Fig. 6과 같이 전극 간 간격이 좁을수록 회수율이 높은 것을 알 수 있다. 전극 간 거리 1 cm에서 거의 완전한 회수율을 보인 반면, 동일한 전기 분해 시간 후 전극 간 거리 3 cm와 5 cm에서는 각각 76%, 64%의 회수율을 보였다. 전극간 거리가 짧을수록 회수율이 높은 것은 Valero et al. (2015)의 연구결과와 일치한다. 따라서 전기 응집을 이용한 미세조류 수확에 있어서 전극 간 간격은 1 cm로 설정하는 것이 적당한 것으로 예상된다.
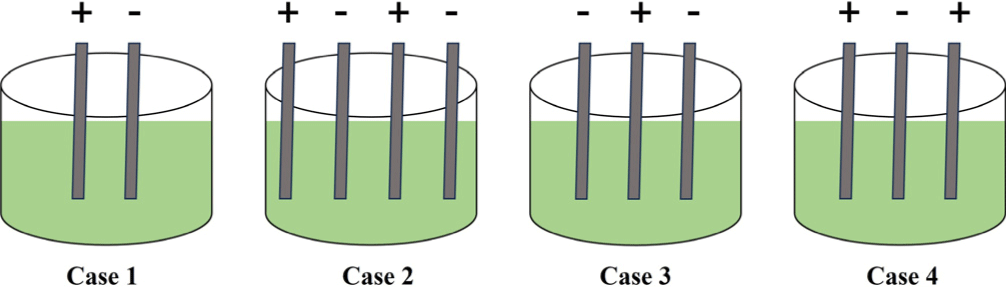
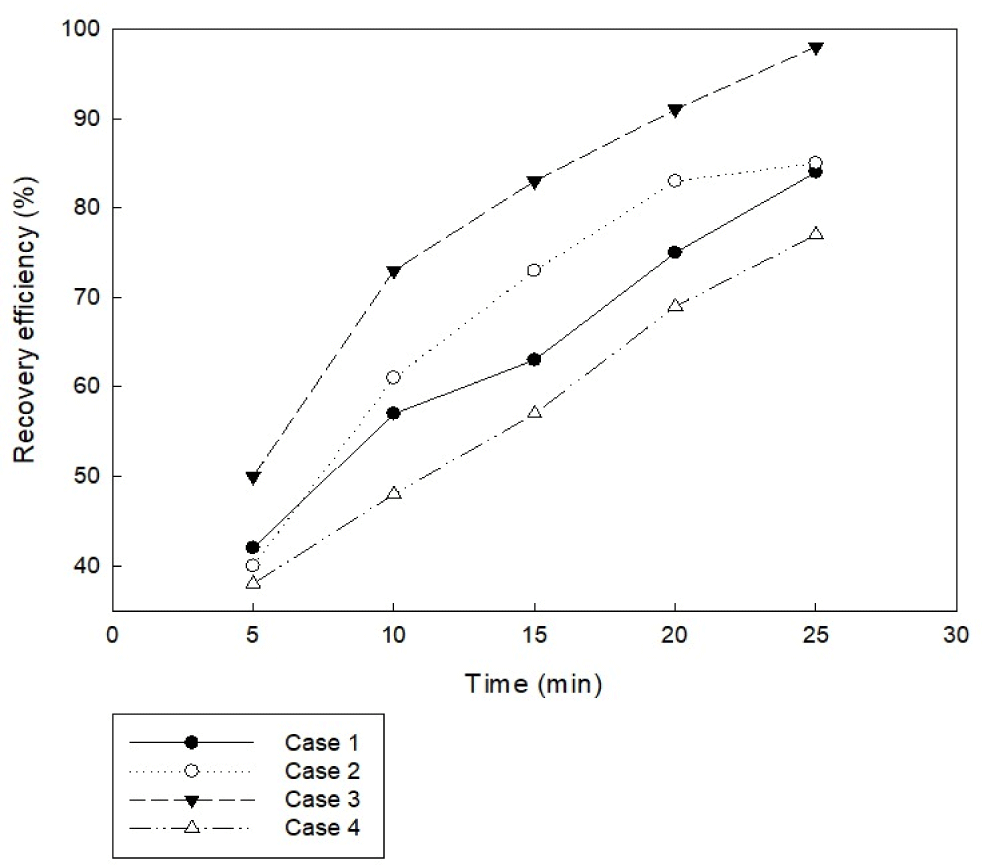
일반적으로 전류의 흐름은 양극에서 음극으로 흐른다. 이때 양극에서는 미세조류의 응집에 영향을 주는 금속이온이 용출되고, 음극에서는 미세 기포가 발생하게 된다. 본 연구에서는 전극 배치를 제외한 모든 조건을 동일하게 설정하여 전극배치 방법에 따른 미세조류 응집 효율을 평가하였다. 본 실험은 미세조류 배양액 초기 pH 5, 교반 속도 100 rpm, 전류 밀도 20 A/m2, 전류 세기 0.2 A, 전극 면적 67.5 cm2, 알루미늄 전극을 사용하는 조건으로 진행하였고, 구체적인 전극 배치 방법은 Fig. 7과 같이 설정하였다. 이때 전극 간격은 최적 조건으로 도출된 1 cm 조건으로 적용하여 실험을 진행하였다. 전극 배치에 따른 미세조류 응집 효율을 평가한 결과 Fig. 8에서 나타낸 바와 같이 case 3(음극-양극-음극)은 전기 응집 15분 반응에서 95%의 높은 응집 효율을 보였다. 또한 case 3(음극-양극-음극)을 제외한 전극 배치 조건에서 20분간 전기 응집 시 95%의 응집 효율을 보였다. Case 3(음극-양극-음극)가 가장 빠른 전기 응집 시간을 보인 것은 미세 기포를 발생시키는 음극이 양극 양쪽에 배치되어 미세 기포의 발생이 원활 했을 것으로 추측된다. 마찬가지로 case 2(양극-음극-양극-음극)도 음극 양쪽으로 양극이 배치되었지만 전극의 수가 총 4개로 반응기 내에서의 금속이온의 용출로 응집효율에 저해를 주었을 것으로 판단된다. 따라서 전기 응집을 이용한 미세조류 수확에 있어서 최적의 전극 배치 조건을 도출한 결과, 미세조류 응집 효울은 case 3(음극-양극-음극) 조건으로 설정하는 것이 적당한 것으로 추정된다.
요 약
최근 대체 단백질 및 대체 육류와 같은 새로운 친환경적인 식량 공급원이 관심을 끌고 있다. 미세조류는 기존의 곡물 자원보다 광합성 효율이 높고 빠른 성장 속도와 짧은 세대시간을 가지는 특징이 있으며 특히 단백질 함량이 높다. 식품 단백질 소재로서 미세조류의 사용을 가로막는 가장 큰 장애물은 고도로 희석된 용액에서 작은 미세조류 세포를 효과적으로 회수하는 것이다. 미세조류 세포는 일반적으로 3~30 µm로 매우 작고, 배양액 농도가 0.2~1 g/L으로 낮으며 세포의 음전하 때문에 미세조류 바이오매스 회수가 매우 어렵다. 현재까지 미세조류를 수확하는 방법으로 원심분리법이나 화학 응집제를 이용하는 수확 방법에 대해 연구가 진행되었으나, 이러한 방법은 수확효율은 좋으나 기기 설치비나 화학적 처리에 따른 독성 물질의 간섭을 배제할 수 없어 미세조류 수확에 있어 적합하지 않다. 반면 전극을 이용하는 전기 응집은 높은 회수율과 처리시간이 짧은 운전 특성을 가지고 있어 미세조류 수확에 응용가능성이 높은 것으로 평가된다. 따라서 본 연구에서는 Scenedesmus obliquus의 회수 수확 증대를 목적으로 교반 여부, 교반 속도, 초기 pH, 전극 재질, 전류 밀도, 전류 세기, 전극 간격, 전극 배치가 미세조류 수확에 미치는 영향을 연구하고, 미세조류를 수확하기 위한 최적 조건을 확립하고자 하였다. 본 연구의 전기응집 실험 결과, 교반속도 100 rpm, 초기 pH 5.0, 알루미늄 전극 사용, 전류밀도 20 A/m2, 전류세기 0.3 A, 전극 간격 1 cm, 전극 배열(–, +, –) 조건에서 S. obliquus의 수확 효율이 가장 높게 나타났다. 이러한 연구 결과는 전기 응집 기술을 미세조류의 수확 방법으로 활용하기 위한 기초 정보로 활용할 수 있을 것이다. 본 연구에서 전기응집은 화학 응집제를 사용하지 않고도 미세조류를 효율적으로 회수할 수 있는 친환경적 수확 기술로 확인되었으나, 동시에 몇 가지 잠재적 한계점이 존재하였다. 우선, 과도한 전류밀도는 전극 표면에서의 전자 이동과 기체 방출 반응을 가속화시켜 세포막의 물리적 손상을 초래할 수 있으며, 이로 인해 단백질·색소 등 세포 내 주요 성분의 변성이나 용출이 일어날 수 있다. 또한, 전극 용출 금속이온은 수산화물 형태로 침전되는 과정에서 세포 표면에 부착되어 금속 잔류를 남길 가능성이 있으며, 이는 식품용 소재화 시 안전성 확보 측면에서 고려되어야 한다. 한편, 전류밀도와 전극 간격의 증가는 전력 소비를 비례적으로 증가시키기 때문에, 산업적 규모로의 적용 시에는 응집 효율과 에너지 효율 간의 공정적 균형 설정이 필요하다. 이러한 한계점들은 운전변수의 정밀 제어를 통해 완화될 수 있다. 예를 들어, 전류밀도는 응집 효율과 세포 손상 간의 균형을 결정하는 핵심 인자로, 20 mA cm–2 이상의 고전류 조건에서는 세포벽 파괴가 보고되었으나, 5∼15 mA cm–2의 저전류 영역에서는 충분한 금속이온 방출을 유지하면서 세포 무손상 수확이 가능한 것으로 알려져 있다. 또한, 전극 재질의 선택은 금속 잔류 특성에 직접적인 영향을 미친다. 알루미늄 전극은 응집 효율이 높지만 세포 표면에 Al(OH)3 잔류 위험이 존재하는 반면, 철 전극은 생체적합성이 상대적으로 높고, 용출된 Fe3⁺가 산화–환원 반응을 통해 쉽게 침전되어 잔류량을 줄일 수 있다. 마지막으로, pH 조절은 금속수산화물의 형태와 표면전하 상태를 결정하는 주요 인자로, 중성 영역(pH 6∼7) 에서는 Al(OH)3가 양전하를 띠어 세포의 음전하를 효과적으로 중화한다. 따라서, 전류밀도–전극 재질–pH의 상호작용을 기반으로 최적 운전영역을 설정하는 것은 세포 손상 최소화, 금속 잔류 저감, 에너지 효율 향상 측면에서 모두 필수적이라 할 수 있다. 또한 본 연구에서 도출된 전기응집 기반 미세조류 수확 조건은 실험실 규모에서 높은 효율을 보였으나, 산업적 규모로의 확장을 위해서는 전력 소모, 전극 내구성, 유지 비용 및 연속 공정 가능성 등을 종합적으로 고려할 필요가 있다. 따라서, 향후에는 공정의 에너지 효율과 운전 안정성을 확보하기 위한 산업 규모 검증이 필요할 것으로 판단된다.