서 론
현대 사회의 급속한 도시화와 식생활의 서구화로 인해 동물성 식품 및 고칼로리 인스턴트 식품의 섭취가 증가하고 있다. 이로 인해 비만, 당뇨, 고혈압 등의 만성질환 유병률이 지속적으로 증가하고 있으며, 건강 유지와 질병 예방을 위한 대체 방안이 요구되고 있다. 이에 따라 단순한 영양 공급을 넘어 건강 증진과 질병 예방 기능을 가진 기능성 식품에 대한 관심이 높아지고 있다(Kim et al., 1998).
효소는 생체 내에서 필수적인 생화학적 반응을 촉진하는 물질로, 일반적으로 충분히 생성되지만, 효소 결핍 시 대사 장애와 면역력 저하를 초래할 수 있다. 이 경우 식품효소를 섭취하면 소화 작용이 원활해지고 대사 활동이 촉진된다(Lee et al., 2015). 효소식품은 발효 및 숙성 과정을 통해 생성된 효소와 생리활성 물질을 다량 포함하여, 건강 증진에 기여할 수 있는 식품으로 정의된다(Huh & Kim, 1997; KFDA, 2022).
효소식품은 2000년대 초반부터 소비자 관심이 증가하면서 다양한 제품이 시장에 출시되었으나, 최근에는 효능과 안전성에 대한 우려로 시장 성장세가 둔화되고 있다(Lee et al., 2015). 이러한 배경 속에서 효소식품의 생리활성 및 효능 증대를 위한 천연소재 활용 연구의 필요성이 강조되고 있다.
메밀(Fagopyrum spp.)은 단백질, 비타민, 식이섬유를 다량 함유한 작물로, 항산화와 항염 효과를 가진 플라보노이드 성분(루틴, 퀘르세틴 등)을 포함한다. 메밀 식물체를 대상으로 rutin 함량을 분석한 결과 종실보다는 식물체 자체에 높다고 보고되었으며, 메밀잎을 이용한 기능성 대용차에 대한 연구에서 페놀화합물 함량과 항산화활성은 성숙한 잎과 꽃에서 높은 활성을 보였다(Park et al., 2005; Jeong et al., 2014). 이때문에 메밀전초(잎과 줄기)는 기능성 식품 개발에 활용 가능성이 높다.
다시마(Laminaria japonica)는 국내 해조류 중 가장 높은 식이섬유 함량(50.7%)을 가지고 있으며, 항산화, 항염, 혈당 및 혈압 조절 등의 다양한 생리활성을 나타낸다(Do et al., 1997). 특히, 다시마에 포함된 알긴산은 체내 콜레스테롤 흡수를 억제하고, 항돌연변이 및 항암, 면역 증강 효과를 가지는 것으로 알려져 있다(Cui et al., 2002; Jung et al., 2019). 다시마는 식이섬유와 알긴산이 풍부하여 건강기능식품 소재로의 활용 가능성이 높다.
메밀전초과 다시마는 플라보노이드와 알긴산 및 식이섬유를 포함한 생리활성 물질을 풍부하게 함유하고 있다. 하지만 이들 천연소재를 활용한 식품 개발 연구는 아직 미흡한 상태이다. 이에 따라 메밀전초와 다시마추출물을 활용한 식품 개발을 통해 기존의 기능성을 더욱 강화하고, 건강 증진 효과를 극대화할 필요가 있다.
본 연구에서는 메밀전초와 다시마 추출물을 효소식품 생산에 활용하여 생리활성 증대 효과를 제시하고, 이를 기반으로 건강기능식품 시장에서의 활용 가능성을 제시하고자 한다.
재료 및 방법
미역귀(Sea mustard ears)와 다시마(Sea tangle)는 강릉 정동진 해녀협회에서, 톳(Fusiformis)은 고성 대진 해녀협회에서 구입하여 시료로 사용하였다. 시료를 깨끗한 물에 1시간 동안 침지 후 3회 세척한 다음 열풍건조기(JW-500ED, Jinwoo Electronic Co., Hwaseong, Korea)를 이용하여 50℃에서 12 h 건조시켰다. 건조한 시료는 조분쇄기(Model SJC, Sung Jin Precision Co., Daegu, Korea)를 사용하여 850 μm(표준체 No. 20) 이하의 크기로 사용하였다.
단메밀(common buckwheat)와 쓴메밀(tartary buckwheat)은 춘천, 메밀전초(buckwheat leaves)는 평창에서 재배된 것을 구입하여 분쇄기로 갈은 후 표준망체(No. 20) 체로 친 뒤 냉장보관하면서 시료로 사용하였다.
Di(phenyl)-(2,4,6-trinitrophenyl) iminoazanium (DPPH), Folin-Ciocalteau‘s phenol reagent, tannin acid, phloroglucinol, dexamethasone, 3-isobutyl-1-methylx anthin 등은 Sigma-Aldrich사 (St. Louis, MO, USA)로부터 구입하여 실험에 이용하였다. 효소식품에 사용된 균주는 전통 누룩으로부터 분리하여 보타노스에서 보관 중인 Aspergillus oryzae BOT1870 (KCTC19020P) 종균을 사용하였다.
총 폴리페놀 함량은 Swain et al. (1959) 방법을 응용하여 측정하였다. 각각의 시료 1 mL에 2% Na2CO3 6 mL를 가한 후 3 min 반응 후 Folin-Ciocalteau’s phenol reagent (Sigma-Aldrich Co., Louis, Mo, USA) 0.6 mL를 가해 30℃에서 30 min 반응시킨 후 UV-spectrophotometer (Model V-560, Jasco Co., Tokyo, Japan)를 사용하여 700 nm에서 흡광도를 측정하였다. Tannin acid (Sigma-Aldrich Co., Louis, Mo, USA)를 표준물질로 사용하여 검량곡선을 작성하고 총 폴리페놀 함량을 구하였다. 플로로탄닌은 DMBA법(Stern et al., 1996)을 이용하여 측정하였다. Phloroglucinol을 표준물질로 하여 얻은 표준곡선으로부터 정량하였다. 일정 농도로 추출된 각 추출시료 10 µL에 HCl을 혼합한 후 1 min 실온 반응하였다. 반응이 끝나면 DMBA solution을 첨가 혼합하고 60 min 30℃ 암소에서 반응한 후 UV-spectrophotometer (Model V-560, Jasco Co., Tokyo, Japan)을 사용하여 510 nm에서 흡광도를 측정하였다.
미역귀, 다시마, 톳 등 3종의 해조류와 메밀전초 분말시료를 각각 10 g을 정밀히 달아 여과백에 넣고 증류수 300 mL를 가해 95℃의 진탕항온수조에서 4 h 추출 후 젖산으로 pH를 5.0으로 조정하였다. 그 후 잔여물과 함께 시료의 0.1%에 해당하는 Plantase PT 효소(mixture of cellulase 75% and pectinase 25%, Bision Co., Seoul, Korea)를 첨가하여 50℃의 진탕항온수조에서 3 h 반응시킨 후 80℃에서 20 min 가열하여 효소 불활성화시켰다. Nylon 여과천으로 1차 여과하고 NO.1, P1 crucible로 여과한 후 감압농축한 후 동결건조하여 수율을 계산하였다.
Di(phenyl)-(2,4,6-trinitrophenyl) iminoazanium (DPPH) radical activity assay는 Blois (1958)의 방법으로 항산화 효과를 확인하였다. 각 시료 일정량을 에탄올에 녹인 후 0.3 mM DPPH 용액 1 mL를 가하고 이것을 1 min 방치한 뒤 UV-spectrophotometer (Model V-560, Jasco Co., Tokyo, Japan)를 사용하여 517 nm에서 흡광도를 측정하여 실험물질 간 라디칼 소거능을 비교분석하였다.
해조류 추출물의 항비만 효능 연구를 위해 3T3-L1 마우스 지방전구세포를 한국세포주은행에서 구매하여 사용하였다. 이 세포주는 10% 소우아혈청 (BCS, bovine calf serum, Gibco, BRL, USA)이 포함된 Dulbecco’s modified Eagle’s medium (DMEM, Gibco)에 1% penicillin-streptomycin (P/S, Gibco, BRL, USA) (Thermo Scientific, MA, USA)을 첨가하여 37℃, 5% CO2로 조정된 배양기에서 배양하였다(Oh & Lee, 2015). 3T3-L1 전지방세포를 지방세포로 분화유도를 위해 3T3-L1 세포를 6-well cell culture plate에 1.0×105 cells/well 농도로 분주하고, 세포가 confluent하기까지 배양한 후, 신선한 배지로 교환하여 48 h 추가 배양하였다. Confluent 상태에서 배양액을 분화유도배지인 10% FBS, 1% P/S, 250 µM dexamethasone(DEXA, Sigma-Aldrich, USA), 0.5 µM 3-isobutyl-1-methylx anthin (IBMX, Sigma-Aldrich, USA) 및 10 µg/mL 인슐린이 함유된 DMEM 배지로 교환하여 2일간 분화를 유도하였다. 분화유도 후 2∼4일차에 배지를 시료 추출물, 10% FBS, 1% P/S, 10 µg/mL 인슐린을 포함한 DMEM으로 교환하였고, 분화유도 6일차부터는 2일에 한번씩 10% FBS, 1% P/S를 포함한 DMEM으로 교환하였으며, 세포의 분화 정도에 따라 분화 시작 후 8∼10일 사이에 실시하였다.
본 연구에서는 Ez-Cytox Enhanced Cell Viability Assay Kit (Daeil Lab Service, Seoul, Korea)를 사용하여 시험물질인 해조류 및 메밀류 추출물에 대한 3T3-L1 세포주의 세포 활성을 측정하였다. 시험물질인 각 추출물을 0.001∼10 mg/mL의 농도로 세포에 적용하여 37℃, 5% CO2 조건 하에서 24 h 배양한 후 세포 활성을 micro plate reader (SpectraMax plus384, Molecular Devices, CA, USA)를 이용하여 450 nm에서 측정하였다. 세포 활성의 변화는 대조군에 비해 시험물질 처치군의 세포 활성 변화 정도를 백분율로 나타내었다.
Oil Red O Staining은 분화 유도 8∼10일차의 3T3-L1 세포에서 실시하였다(Ramirez-Zacaarias et al., 1992). 10% FBS DMEM 배지를 제거한 후, 10% formalin을 1 mL 넣고 4℃에서 1 h 동안 보관해 세포들을 고정시켰다. 고정된 세포는 세포 내 생성된 지방구와 특이적으로 반응하는 Oil Red-O로 1 h 동안 염색한 후, 증류수를 이용해 3번 세척하였다. 염색된 세포들은 건조시켜 100% 아이소프로페놀을 500 µL를 첨가하여 Oil Red-O를 용출시켜 micro plate reader로 500 nm에서 흡광도를 측정하였다. Oil Red O contents (%)를 [Oil Red O contents (%)=(시료처리군의 흡광도/대조군의 평균 흡광도)×100]으로 계산하였다. Peroxisome proliferator-activated receptorγ (PPAR-γ) 발현 정도를 통해 각각 추출물의 발현억제를 확인하였다.
종균용 베이스는 밀기울 1%, 대두분말 1%, 미강 1%, 효모추출물 0.5%를 함유하는 배양액 50 mL를 제조하여 고압멸균기에서 121℃에서 15 min 동안 멸균하였다. 고체배양한 균주 Aspergillus oryzae BOT1870 (KCTC19020P)를 직경 6 mm 크기로 잘라 접종하여 30℃ 교반기에서 120 rpm으로 24 h 배양하여 종균을 제조하였다. 본 발효는 Table 1에서의 비율로 하여 원료를 세척하고 수분 함량이 36%가 되도록 메밀 1 h, 서목태 2 h 동안 침지하였다. 다시마분말을 첨가한 후 95∼100℃에서 1 h 동안 증자하여 냉각시킨 후 종균을 1% 비율로 접종하였다. 항온항습조(25℃, 90% 습도)에서 하루에 2∼3회 잘 섞어주면서 48 h 발효시켰다(So & Lee, 2009). 발효된 곡류효소를 열풍건조기(JW-500ED, Jinwoo Electronic Co., Hwaseong, Korea)를 이용하여 40℃에서 12 h 동안 건조하여 분쇄기(Seung Jin Precision Co., Seoul, Korea)를 사용하여 850 μm(표준체 No. 20) 이하의 크기가 되도록 분쇄하였다.
| Raw materials | Mixing rate (%) |
|---|---|
| Buckwheat | 80 |
| Sea tangle powder | 9 |
| Black soybean | 7 |
| Aspergillus oryzae | 1 |
| Buckwheat leaves · Sea tangle extract | 3 |
| Total | 100 |
알긴산 함량은 Nishide et al. (1988)이 확립한 방법을 변형하여 측정하였다. 분쇄한 시료를 증류수와 1:30 w/v의 비율로 75℃에서 30 min 교반하면서 가열한 후 nylon cloth를 이용하여 여과하였다. 잔사는 1%에 1% Na2CO3로 추출하고, HCl로 pH를 조절하고 50% 에탄올을 첨가하여 잔여물을 측정하는 알칼리 알긴산 함량을 구하였다. 시료의 총식이섬유 함량은 식품공전방법 (KFDA, 2022)에 의하여 분석하였다.
결과 및 고찰
Plantase PT(Bision Biochem, Seoul, Korea)는 펙티나아제(pectinase), 셀룰라아제(cellulase), 헤미셀룰라아제(hemicellulase) 등을 포함하는 상업용 효소로, 주로 과실 및 채소 농축액 제조 시 조직 분해와 수율 향상을 목적으로 사용된다. Pectinase와 같은 효소는 식물체에 많이 분포하고 있는 세포벽 다당류를 분해하여 세포조직의 결착을 약화시킴으로써 추출 효율을 높이는데 기여한다(Lee, 2009). 효소처리 과정에서 다시마의 추출수율은 처리 전 29.8%에서 처리 후 40.0%로 34% 증가하였고(Table 2), 메밀전초의 경우 17.2%에서 26.9%로 56%의 수율 증가를 보였다.
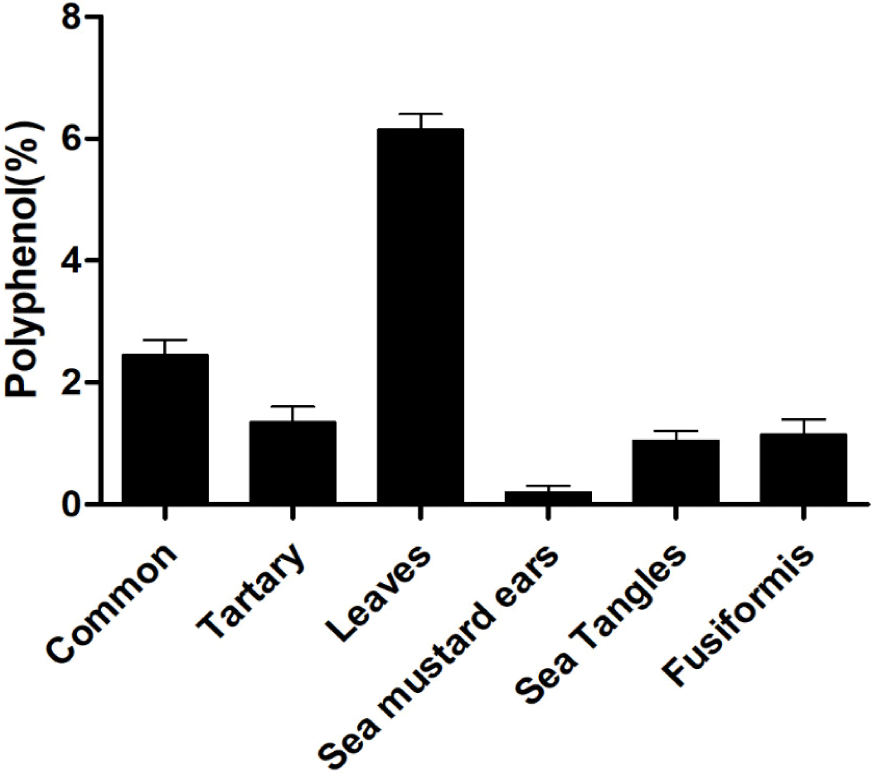
본 연구에서는 단메밀, 쓴메밀, 메밀전초, 미역귀, 다시마, 톳 등의 폴리페놀 함량을 비교 분석하였다. 그 결과, 메밀전초가 6.4%로 가장 높은 폴리페놀 함량을 보였고, 이는 Ko (2016)의 연구에서 보고된 2.74%와 차이를 보인다. 특히, 본 실험에서 메밀전초는 다른 시료들과 비교하여 두 배 이상 높은 폴리페놀 농도를 나타냈으며, 이는 메밀전초의 항산화 활성 및 건강 기능성 가치가 있는 것으로 판단되어진다(Fig. 1).
단메밀과 쓴메밀은 각각 2.7%와 1.6%의 폴리페놀 함량을 보였고, 이는 메밀전초에 비해 상대적으로 낮은 수준이다. 미역귀, 다시마, 톳 등의 해조류는 0.3∼1.4%의 폴리페놀 함량을 나타냈으며(Fig. 1), 일반적으로 곡류에 비해서는 낮은 폴리페놀 함량을 보였다.
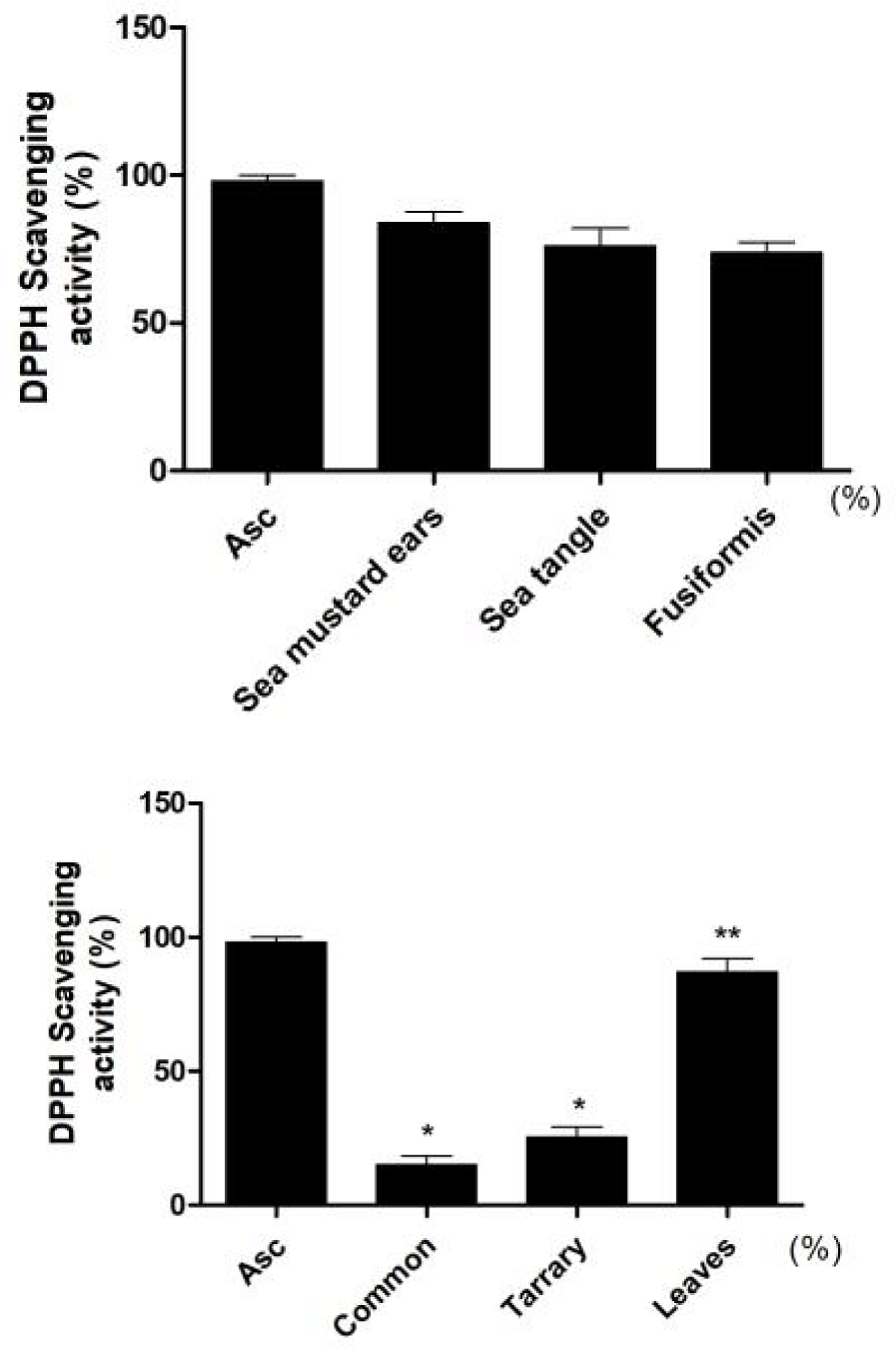
해조류와 메밀시료 추출물의 항산화효과를 알아보기 위하여 DPPH 라디칼소거 활성을 비교한 결과, 미역귀와 다시마에서 80% 이상의 소거능이 나타났으며, 메밀에서는 메밀전초의 소거활성이 단메밀이나 쓴메밀 시료보다 높게 나타났다(Fig. 2).
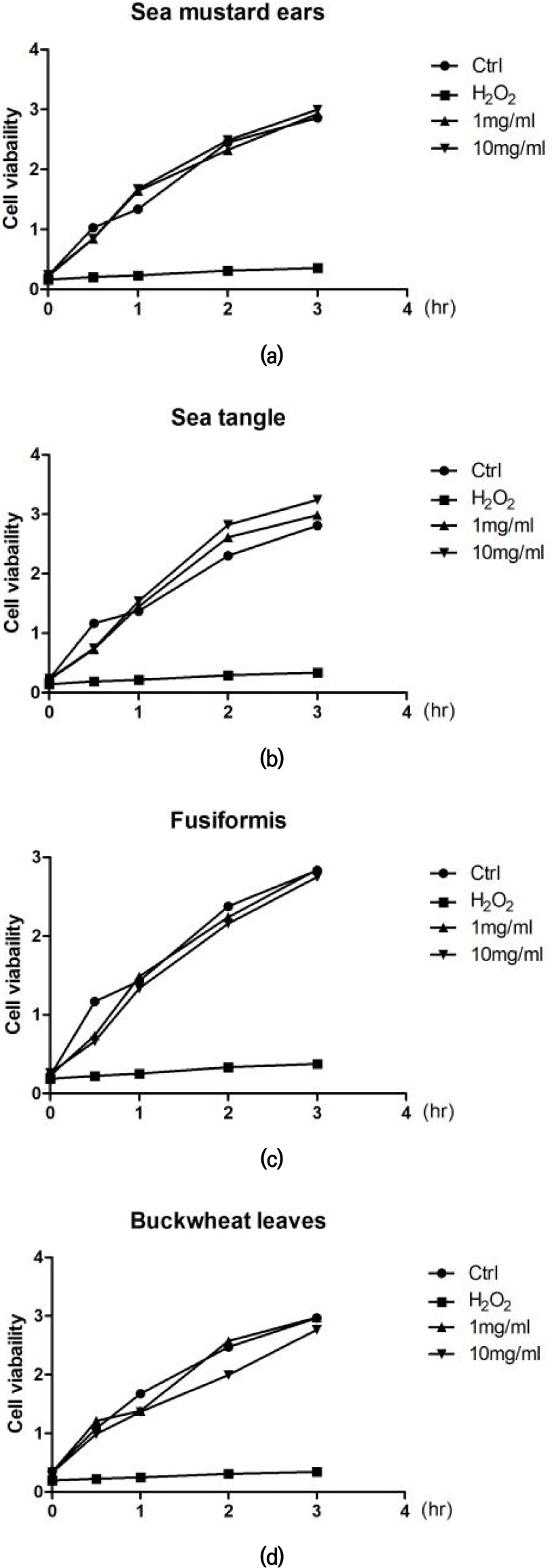
미역귀, 톳, 다시마 및 메밀전초 추출물이 3T3-L1 세포 활성에 미치는 영향을 평가한 결과, 1 mg/mL 농도까지 세포 활성에 유의미한 저해 효과가 나타나지 않았다(Fig. 3). 사용된 추출물들이 3T3-L1 세포의 생존율에 대해 안전한 농도 범위에서 작용함을 확인하였다.
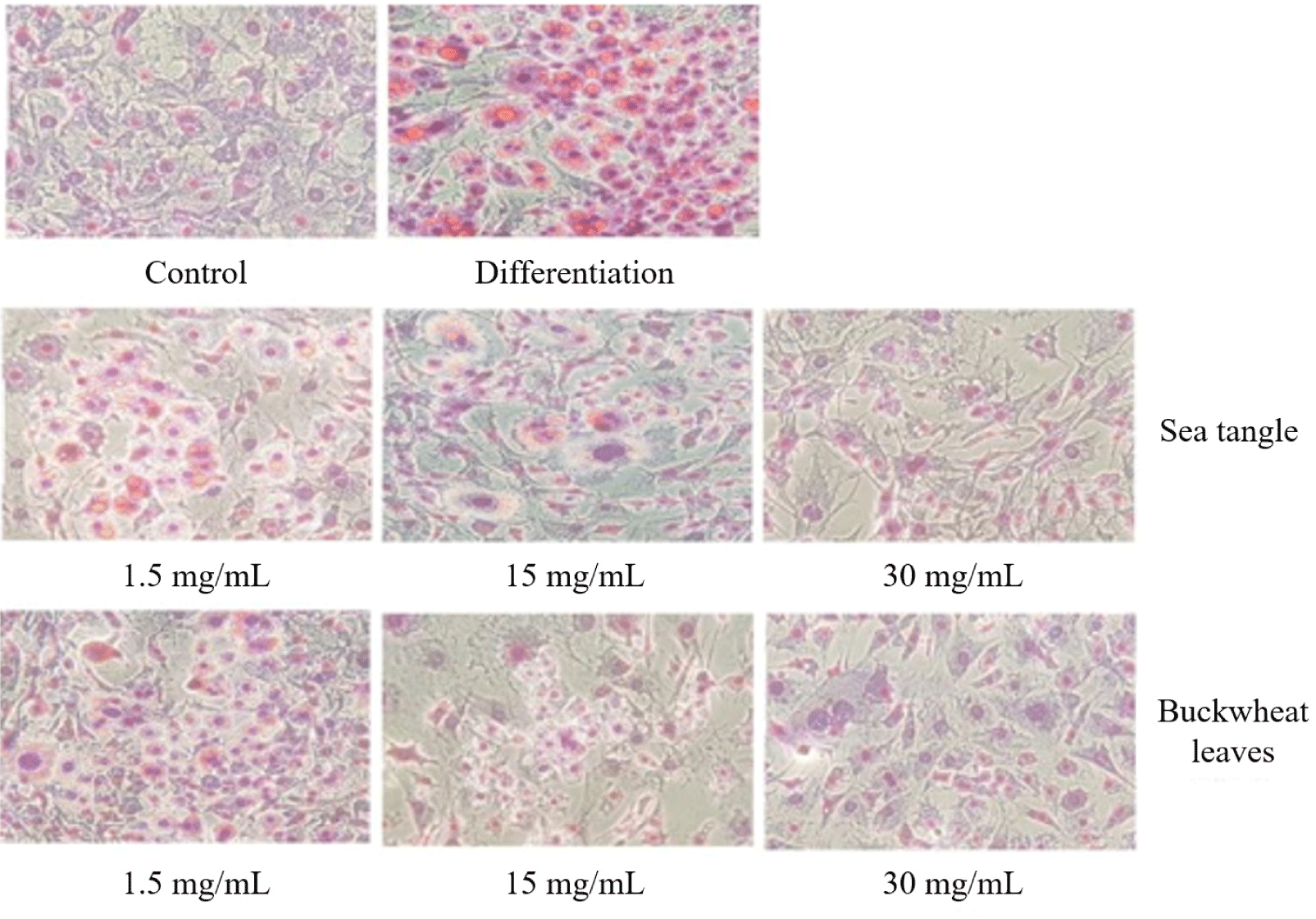
다시마 열수추출물로 처리한 후 Oil Red O Staining 관찰한 결과 1.5 mg/mL부터 지방분화 억제 효능이 관찰되었으며, 염색된 Oil red O만을 따로 용출시켜 측정하였을 때 농도별로 지방분화 억제 효능을 분석하여 지방전구세포인 3T3-L1 세포에 다시마 및 메밀전초 추출물을 1.5 mg, 15 mg 및 30 mg/ml 처리한 결과, 모든 농도에서 감소효과가 확인되었으며 Oil-red O를 용출하여 비교한 결과 1.5 mg 처리시 50% 이상의 지방분화 감소를 보였다(Fig. 4).
Son (2017)은 3T3-L1 세포에 다시마추출물을 0.5 mg 및 1 mg/mL을 처리한 결과 모든 농도에서 지방분화를 감소시킨 것으로 보고한 바 있다. 녹차의 건조잎 중에는 8∼20% 정도의 폴리페놀성분인 카테킨이 함유되어 있으며, 마우스를 사용하여 녹차카테킨의 비만에 대한 유효성평가를 하여 녹차카테킨 섭취가 식이의존성의 체지방축적을 억제하는데 유효하다고 보고되었다(Lee et al., 2007).
쓴메밀과 단메밀 에탄올추출물을 이용한 3T3-L1 전구지방세포를 이용한 항비만 활성을 평가한 결과에서 대조구에 비해 메밀 에탄올추출물들은 지방생성 억제 효과가 있으며 이러한 결과는 항산화 효과와 연관되는 것으로 보고되었다(Yoon et al., 2012).
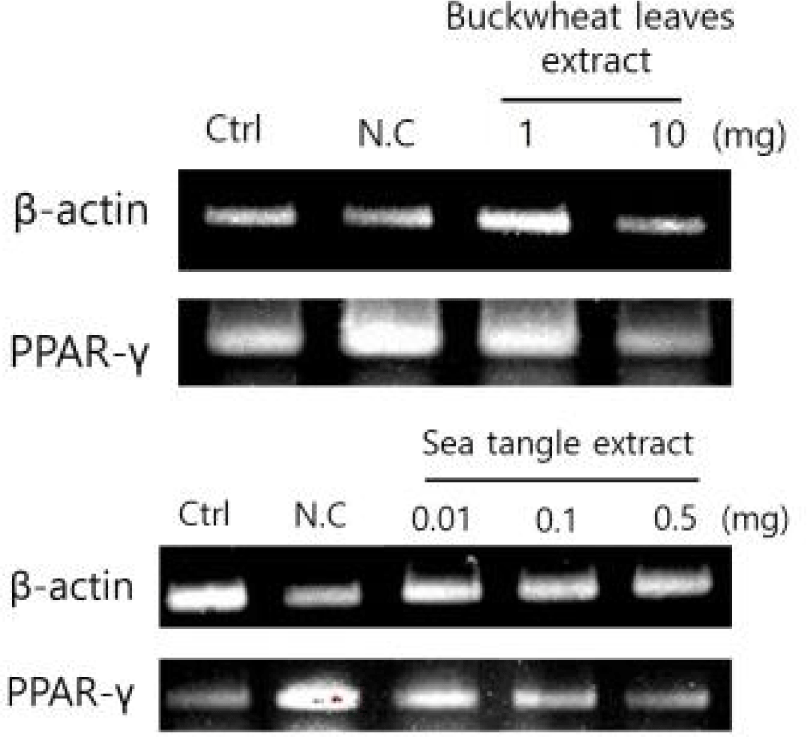
자극에 대한 세포의 반응을 확인하기 위해 RT-PCR을 수행하여 각각의 세포주가 시험물질에 반응하여 나타내는 유전자 발현 변화를 확인하였다. 각 추출물을 처리하면서 분화시킨 3T3-L1 지방전구세포에 TRIzol(Invitrogen Co., Carlsbad, Ca, USA)법으로 total RNA를 추출하였으며, 1.0 μg의 total RNA를 정량하여 역전사하였다. PCR을 통해 유전자의 발현을 확인하였으며 housekeeping gene인 β-actin에 normalization 시킨 band와 비교 분석하였다. 본 연구에서 메밀전초 10 mg/mL 추출물로 처리하였을 때는 PPAR-γ의 발현억제를 확인할 수 있었으며, 다시마 0.1 mg/mL 추출물로 처리하였을 때 PPAR-γ의 유전자 발현패턴에서 대조군보다 감소함이 확인되어 지방분화 발현억제를 확인할 수 있었다(Fig. 5).
본 연구에서 아밀라제 활성도는 현미효소에서 5,588 unit/g, 메밀해조류효소 36,697 unit/g으로 메밀해조류효소가 현미효소보다 6.5배 높았으며, 프로테아제 활성도는 현미효소 49.76 unit/g, 메밀해조류효소 1,349 unit/g으로 현미효소에 비하여 27배 높았다(Table 3). 본 결과는 메밀해조류효소가 아밀라제와 프로테아제 활성을 크게 증대시키는 효소원으로 활용될 수 있는 가능성 및 식품산업에서의 활용가능성을 확인하였다.
| Products | α-amylase (U/g) | Protease (U/g) |
|---|---|---|
| Brown rice | 5,588±54.0b1) | 49.8±1.8b |
| Buckwheat · sea tangle | 36,697±25.6a | 1,349±3.5a |
곡류효소가 건강에 미치는 영향을 파악하고, 이를 통해 효소의 기능성을 평가하기 위해 진행하였다. 식이섬유는 장 건강 및 심혈관 질환 예방에 기여하며, 알긴산은 체중 관리 및 독소 제거에 도움을 준다. 또한, 항산화능은 활성산소로 인한 세포 손상을 방지하는 데 중요한 역할을 한다.
본 연구에 사용된 재료의 분석 결과 현미효소의 식이섬유 함량은 8.1%이었으며, 메밀해조류 효소는 100 g당 식이섬유가 15.3 g으로 2배 가까이 함유되어 있어 이를 활용한 제품개발 시 체중조절 등에 도움을 줄 수 있을 것으로 사료된다(Table 4). 현미효소에는 알긴산이 거의 들어 있지 않으나 메밀해조류효소에는 7.8%의 알긴산이 함유되어 있어 체중조절에 도움이 될 것으로 사료된다. 메밀해조류효소는 현미효소에 비하여 2배 가까이 많은 양의 폴리페놀을 함유하는 것으로 나타났다.
플로로탄닌은 여러 가지 메카니즘을 통해서 항산화성, 항알레르기성, 항당뇨, 항고지혈증 및 항바이러스 작용, lipase 저해작용 등 여러 가지 생리활성을 가지는 것으로 보고되고 있다(Jung et al., 2012). 메밀해조류 효소는 현미효소에 비하여 플로로탄닌이 31.2% 증가되었다. 또한, DPPH 소거능은 현미효소에서 39.9%였으며, 메밀해조류효소에서는 77.8%로 현미효소에 비하여 195.0% 이상 높은 수치를 보였다.
요 약
메밀전초와 다시마를 열수로 추출 후 plantase 효소처리를 한 결과 메밀전초의 추출 수율은 56% 증가하였으며, 다시마는 34% 증가하였다. 3T3-L1 전지방세포에서 실시한 세포독성 실험결과 1 mg/mL의 농도로 대조군과 비교하여 유의적인 세포독성을 일으키지 않았다. 전지방세포를 지방세포로 분화시키는 과정에서 메밀전초 추출물과 다시마추출물이 미치는 영향을 살펴보기 위하여 3T3-L1 전지방세포의 분화와 동시에 추출물을 농도별로 처치하여 분화를 진행한 결과, 메밀전초 추출물은 10 mg/mL, 다시마추출물은 0.1 mg/mL 농도에서 지방분화억제를 확인할 수 있었다. 메밀다시마효소는 현미효소에 비해 아밀라제는 6.5배, 프로테아제는 27배 높았으며, 식이섬유, 폴리페놀, DPPH 소거능 등에서 2배 이상 높았다. 메밀해조류효소는 현미효소식품에는 없는 알긴산을 7.8% 함유하였으며, 플로로탄닌 성분은 31.2% 더 많이 함유하였다.
본 연구를 통해 메밀전초과 다시마가 효소처리를 통해 생리활성 성분이 증대될 수 있다는 점을 확인하였다. 특히, 메밀전초와 다시마의 추출물이 지방세포 분화 억제와 같은 항비만 효과를 보였으며, 효소식품으로서의 가능성을 높이는 결과를 도출하였다. 또한, 이들 원료가 풍부한 식이섬유와 폴리페놀, 알긴산 등의 성분을 포함하고 있어 건강기능식품으로 활용될 수 있는 잠재력이 높다. 따라서 메밀전초와 다시마를 활용한 효소식품은 비만 예방, 항산화, 항염, 혈당 조절 등 다양한 건강 효과를 기대할 수 있으며, 이러한 효소식품의 산업적 개발과 상용화가 가능할 것으로 판단된다.