서 론
용과(Pitaya, Dragon fruit)는 선인장과(Selenicereus)에 속하며 학명은 Hylocereus polyrhizus로서 사막에서 자라는 다육식물의 일종인 CAM(crassulacean acid metabolism) 식물이다(Anderson, 2001). 원산지는 멕시코와 중남미이지만, 최근 제주에서는 과피와 과육색이 붉은 적색종 용과 ‘대홍(Dahong)’ 품종을 대만에서 도입하여 생산하고 있다(Lee et al., 2022). 과육이 흰색인 백색종 용과는 1999년 베트남에서 제주에 도입되어 재배기술 연구는 다수 이루어져 있으나, 적색종 용과의 기능성 관련 연구는 매우 부족한 실정이다.
용과에는 안토시아닌, 라이코펜, 비타민 E 등 다양한 기능성 성분들이 함유되어 있어(Charoensiri et al., 2009) 항암, 항염증과 심혈관 질환 감소 등의 기능성이 보고되어 건강 기능성 소재로서 주목을 받고 있다(Cos et al., 2004). 식물 유래의 2차 대사산물인 페놀 화합물(phenol compounds) 및 휘발성 향기 성분 등의 2차산물 혹은 그 유도체들은 활성산소에 의한 산화를 억제하여 항산화 활성을 나타낸다는 보고가 있다(Lee et al., 2009; Cho et al., 2020). 적색종 용과 과육과 과피에는 항산화 물질인 폴리페놀(polyphenol) 화합물이 다량으로 포함되어 있는데, 이들은 수산화라디칼(hydroxy radical, OH), 과산화라디칼(hydroperoxy radical, HO2), 초과산화물 라디칼(superoxide anion radical, O2–) 등의 다양한 활성산소종(reactive oxygen species, ROS)을 효과적으로 제거하는 강력한 항산화제로 작용한다(Urquiaga & Leighton, 2000). 활성산소종의 과도한 생성은 세포 내 산화적 스트레스를 유발하여 생체 내 세포막, 단백질, DNA 손상 등을 일으켜 피부 색소 침착, 비만, 노화 등을 야기한다고 밝혀진 바 있다(Lee et al., 2009; Valko et al., 2007).
본 연구에서는 제주에서 재배하고 있는 적색종 용과의 활용도를 높일 목적으로 용과를 과육과 과피로 분리하여 열수, 에탄올 추출을 거친 추출물의 항산화 물질인 폴리페놀 함량, 항산화 활성(ABTS 라디칼 소거능, DPPH 라디칼 소거능), 미백 효과(Mushroom tyrosinase 활성 저해 효과) 및 항비만 효과(세포 독성, Oil-red O 염색을 통한 지방축적 감소 확인)를 분석하였다. 메탄올, 헥산 등과 같은 유기용매 추출은 미용, 건강기능 식품소재로 활용하기 위해 가공과정 중 유기용매를 제거하는 과정이 필요하고, 추출용매의 잔류독성에 대한 안전성 문제가 발생한다는 단점이 있다(Oh & Yoon, 2017). 반면 70% 에탄올 추출물은 물에 잘 녹지 않는 생리활성 물질들을 용해시켜 추출이 용이해진다고 하였고, 열수 추출물은 주로 가용성 성분이 추출되며 열처리 온도와 시간이 증가할수록 페놀성 물질과 같은 생리활성물질이 추출되어 항산화 활성이 증가하지만, 열에 민감한 물질들이 고온에서 손실된다는 단점이 있다고 보고되었다(Lim et al., 2019). 본 연구에서는 제주산 적색종 용과 과육과 과피의 70%에탄올과 열수 추출방법에 따라 제조한 추출물의 항산화, 미백, 항비만 생리활성 효능을 과학적으로 입증하여 생과 소비를 촉진하고, 향후 버려지는 껍질을 활용하여 미용, 건강 기능성 소재로 활용하기 위한 기초 자료를 제공하고자 하였다.
재료 및 방법
본 실험에서 사용한 적색종 용과(Hylocereus polyrhizus)는 제주특별자치도 제주시 조천읍에서 2023년에 재배된 ‘대홍(Dahong)’ 품종이며, 과피와 과육을 분리 후 동결건조(PDF 28, MC-tech, Busan, Korea) 및 분쇄하여 4°C에 보관하면서 실험에 사용하였다.
적색종 용과 추출을 위해 과피와 과육을 분리 후 용매로 에탄올과 물을 이용하였으며, 각 건조 분말의 20배 용매를 가한 후 추출하였다. 95% 에탄올을 70% 농도로 희석하여 추출용매로 사용하였으며, 상온에서 24시간 추출하여 감압농축(Rotary vaccum evaporator, Rotavapor R-300, Buchi, Flawil, Switzerland)한 후 동결건조하였다. 열수 추출물은 시료를 100°C에서 4시간 추출한 후 동결건조(PDF 28, MC-tech, Busan, Korea)하여 밀봉한 뒤, –20°C에 보관하여 실험에 사용하였다.
총 폴리페놀 함량은 phenolic compounds assay kit(K527, BioVision, Milpitas, CA, USA)를 이용하여 Folin-ciocalteu 방법에 따라 분석하였다 (Slinkard & Singleton, 1977). 적색종 용과 과육과 과피 추출물 희석 시료 100 μL, Folin-ciocalteudl이 포함된 용액 100 μL을 상온에서 10분간 교반기로 균일하게 반응시킨 후 microplate reader(Gen 5, Biotek Instruments, Winooski, VT, USA)를 이용하여 480 nm에서 흡광도를 측정하였다. 총 폴리페놀 함량은 catechin을 표준물질로 하여 검량선을 작성한 후 계산하였다.
2,2'-Azinobis(3-ethylbenzothiazoline-6-sulfonic acid(ABTS) 라디칼 소거능은 ABTS antioxidant capacity assay kit(KF01002, BQC redox technologies, Asturias, Spain)를 이용하여 Nicoletta(2019)의 방법을 변형하여 분석하였다. ABTS, potassium persulfate를 혼합하여 만든 후 라디칼이 생성된 ABTS 용액 200 μL과 적색종 용과 과육과 과피 추출물 희석 시료 5 μL을 상온에서 10분간 균일하게 암실에서 교반한 후, microplate reader(Gen 5, Biotek Instruments, Winooski, VT, USA)를 이용하여 734 nm에서 흡광도를 측정하였다. Vitamina C를 표준물질로 하여 검량선을 작성한 후 소거활성을 백분율로 표시하였다.
1,1-Diphenyl-2-picrylhydrazyl (DPPH) 라디칼 소거능은 DPPH antioxidant assay kit(K2078, BioVision, Milpitas, CA, USA)를 이용하여 Blois의 방법을 변형하여 분석하였다(Blois, 1958). 0.6 mM DPPH 용액 100 μL과 적색종 용과 과육과 과피 추출물 희석 시료 100 μL를 상온에서 10분간 균일하게 암실에서 교반한 후 microplate reader(Gen 5, Biotek Instruments, Winooski, VT, USA)를 이용하여 517 nm에서 흡광도를 측정하였다. Trolox를 표준물질로 하여 검량선을 작성한 후 소거활성을 백분율로 표시하였다.
시료 20 μL, 1 mM L-tyrosin 20 μL, 0.1 M potassium phosphate buffer(pH 6.8) 150 μL, 머쉬룸 타이로시나제액(1,600 Unit/mL)을 넣고 37°C에서 20분간 균일하게 암실에서 교반한 후, microplate reader(Gen 5, Biotek Instruments, Winooski, VT, USA)를 이용하여 450 nm에서 흡광도를 측정하였다. 시료에 의해 타이로시나제 활성 억제 수치가 클수록 타이로시나제 억제제로서 효과적으로 작용한다고 판별하였다.
본 실험에서 마우스 유래 전구지방세포 3T3-L1세포(ATCC, Manassas, VA, USA)를 10% newborn calf serum(BCS; Gibcco, Grand island, NY, USA), 1% penicillin-streptomycin (P/S; Welgene, Deagu, Korea)이 첨가된 Dulbecco's Modified Eagle Medium (DMEM; Gibco, Grand island, NY, USA)을 사용하여 37°C, 5% CO2 incubator에서 배양하였다. 96-well plate에 1×104 cells/well로 접종한 후 세포가 안정화될 수 있도록 24시간 동안 배양한다. 농도별로 희석된 시료를 주입한 뒤 추가로 48시간 배양한 다음 1 mg/mL 농도로 MTT 시약을 첨가하였다. MTT formazan은 DMSO로 녹여 microplate reader(Gen 5, Biotek Instruments, Winooski, VT, USA)를 이용하여 570 nm에서 흡광도를 측정하였다.
세포 분화를 위해 전구지방세포를 6-well plate에 1×105 cells/well로 접종한 후 48시간 동안 배양하여 세포가 충분히 밀집될 때까지 BCS를 포함한 배지로 48시간마다 교환하며 배양하였다. 100% confluent 상태가 된 후 분화유도 배지로 교환하여 분화를 개시하였다(분화유도 0일째). 분화유도 배지는 10% fetal bovine serum (FBS; Gibcco, Grand island, NY, USA), 1% P/S, 1 μM dexamethasone(Dex; Sigma, St. Louis, MO, USA), 0.5 mM 3-isobutyl-1-methylxanthine (IBMX; Sigma, St. Louis, MO, USA) 및 10 μg/mL insulin(Ins; Sigma, St. Louis, MO, USA)이 포함된 DMEM 배지이다. 분화유도 2일 후에 세포 배양액을 10% FBS, 1% P/S 및 10 μg/mL Ins이 포함된 DMEM 배지로 교환하였고, 분화유도 4일 째에는 10% FBS, 1% P/S만 포함된 DMEM 배지로 교환하여 3일간 더 분화유도 하였다. 분화유도 0일째부터 배지를 교환할 때마다 시험물질을 농도 별로 처리하면서 배양하였다.
Oil-red O 염색은 분화 유도 물질과 시료를 동시에 처리 후 7일째 실시하였다. 분화 유도된 3T3-L1 세포를 phosphate buffered saline(PBS, Gibco, Grand island, NY, USA)로 1회 세척한 후, 3.7% formalin(Sigma, St. Louis, MO, USA)로 1시간 동안 고정하고 증류수로 세척하여 완전히 물기를 제거하였다. 증류수로 희석한 Oil-red O 염색약(Sigma, St. Louis, MO, USA)을 넣어 1시간 동안 염색하였다. Oil-red O 염색약은 증류수와 6:4 비율로 희석하였으며, syringe filter로 여과하여 사용하였다. 세포 염색 후 4% Nonidet NP-40(Amresco, Solon, Ohio, USA)이 포함된 isopropanol(Amresco, Solon, OH, USA)를 첨가하여 지방 특이적으로 염색된 Oil-red O를 다시 용해시킨 후 520 nm에서 흡광도를 측정하였다.
실험은 모두 3회 반복 측정하였고 실험 결과는 평균±표준편차(mean±standard deviation)로 표시하였으며, 통계처리는 IBM SPSS Statistics 25(Statistical Package for Social Science, Chicago, IL, USA)를 이용하여 일원분산분석(one way ANOVA) 후, 던컨의 다중검정법(Duncan’s multiple range test)에 따라 사후검정을 실시하여 유의차를 p<0.05 수준으로 비교 분석하였고, Student’s t-test로 *p≤0.05, **p≤0.01 수준에서 비교 분석하였다.
결과 및 고찰
폴리페놀은 식물에서 유래한 2차 대사산물로, 방향족 고리에 hydroxyl 그룹을 가지기 때문에 단백질 및 기타 거대 분자들과 쉽게 결합하며, 항산화, 항노화, 항균, 항암, 항비만 등의 다양한 생리활성을 가지는 것으로 보고되었다(Tsao, 2010). 적색종 용과의 부위 및 추출조건에 따른 추출물의 총 폴리페놀 함량은 Table 1에 제시하였다. 적색종 용과 과육과 과피 부위별 70% 에탄올, 열수 추출조건을 이용하여 얻은 각 추출물에 대하여 총 폴리페놀 함량을 측정한 결과, 과육 70% 에탄올 추출물 36.0±2.23 mg catechin/g, 과육 열수 추출물 34.1±8.30 mg catechin/g, 과피 70% 에탄올 추출물 58.3 ±3.70 mg catechin/g, 과피 열수 추출물 45.8±4.21 mg catechin/g이었다. 총 폴리페놀 함량은 적색종 용과의 과피가 과육보다 높았고, 70% 에탄올 추출물이 열수 추출물보다 높은 경향을 나타냈다. 이는 백색종 용과 과피의 총 폴리페놀 함량이 과육에 비해 약 4.3배 이상 높다는 보고(Saenjum et al., 2021)와 유사한 결과였다.
| Red fleshed pitaya part | Extraction solvent | Total polyphenol content mg Catechin equivalents (CE)/g |
|---|---|---|
| Flesh | 70% EtOH | 36.0±2.23a |
| Water | 34.1±8.30a | |
| Peel | 70% EtOH | 58.3±3.70c |
| Water | 45.8±4.21b |
스트레스, 자외선, 유해물질 등은 반응성이 큰 활성산소종을 발생시키며, 이로 인해 세포에 가해지는 과도한 산화적 스트레스가 세포 손상, 멜라닌 생성 증가, 비만 등 다양한 질병을 유발한다. 항산화물질은 이러한 활성산소종을 제거하여 염증 발생을 감소시켜 기미, 비만, 노화 등을 개선하는 데 효과적이다.
적색종 용과 부위 및 추출 조건별 추출물의 ABTS 라디칼 소거 활성능은 Fig. 1에 제시하였다. ABTS는 비교적 안정한 자유 라디칼로 potassium persulfate와 반응시키면 ABTS 라디칼이 생성되는데, ABTS 라디칼은 시료의 항산화 활성에 의해 고유의 청록색이 탈색되는 원리를 이용하여 항산화력을 측정할 수 있다(Oh et al., 2016; Lee, 2017).
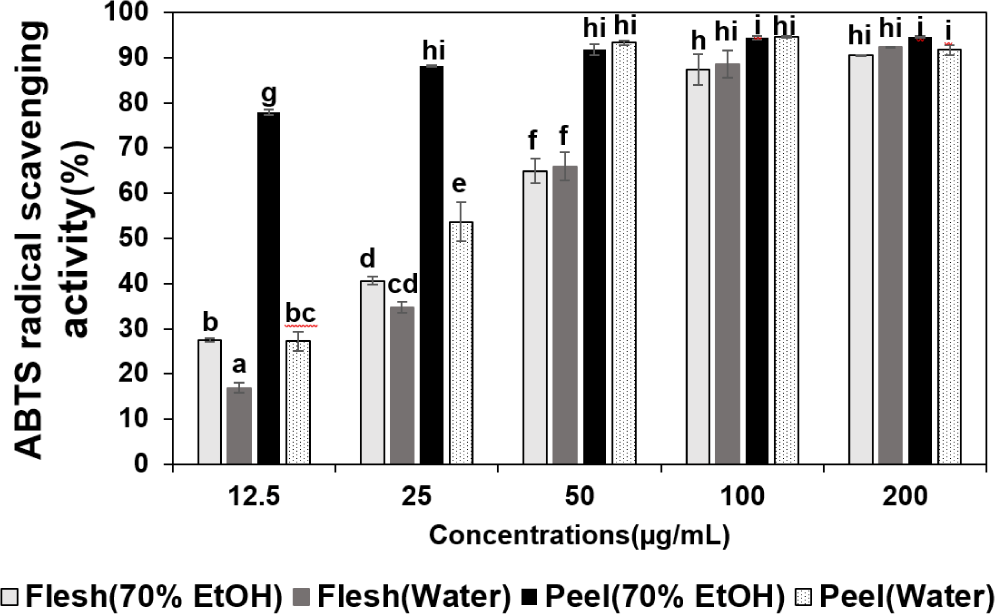
본 연구에서 ABTS 라디칼 소거활성은 적색종 용과 부위 및 추출조건에 따른 추출물을 12.5, 25, 50, 100, 200 μg/mL 농도별로 처리하여 측정하였다. 무처리구 대비 과육 70% 에탄올 추출물의 ABTS 라디칼 소거활성은 각각 27.54, 40.62, 64.89, 90.48%, 과육 열수 추출물은 16.94, 34.79, 65.94, 88.57, 92.27%로 확인되었다. 과피 70% 에탄올 추출물은 77.85, 88.12, 91.82, 94.32, 94.55%, 과피 열수 추출물은 27.19, 53.65, 93.31, 94.62, 91.67%로 확인되었으며, 농도가 증가함에 따라 ABTS 라디칼 소거활성은 증가하는 경향이었다. 각 추출물의 ABTS 라디칼 소거활성을 비교하였을 때, 12.5 μg/mL 농도에서 70% 에탄올 과육 추출물이 77.85%로 가장 높게 나타났으며, 과육보다 과피가 높았고, 70% 에탄올 추출물이 열수 추출물보다 높은 경향을 나타냈다. 이는 백색종 용과 과피가 과육보다 ABTS 라디칼 소거활성이 약 4배가량 높게 나타났다는 보고(Suh et al., 2014)와 유사한 결과였다.
적색종 용과의 부위 및 추출 조건별 추출한 추출물을 12.5, 25, 50, 100 μg/mL 농도별로 처리하여 DPPH 라디칼 소거 활성능은 Fig. 2에 제시하였다. DPPH 라디칼은 시료의 항산화 활성을 가진 물질과 만나면 환원되어 보라색에서 노란색으로 탈색되는 원리를 이용해 항산화력을 측정하였다. 무처리구 대비 과육 70% 에탄올 추출물의 DPPH 라디칼 소거활성은 각각 78.66, 79.10, 80.03, 88.49%, 과육 열수 추출물은 71.96, 73.06, 78.22, 82.81%로 확인되었다. 과피 70% 에탄올 추출물은 91.70, 102.44%로 확인되었고, 50 μL/mL 농도 이상에서 흡광도 측정범위를 벗어나 항산화 효과를 측정할 수 없었다. 과피 열수 추출물은 79.89, 88.88, 94.51%로 확인되었고, 100 μL/mL 농도에서 흡광도 측정범위를 벗어나 항산화 효과를 측정할 수 없었다. 항산화 효과가 뛰어난 물질은 DPPH 라디칼과 만나면 낮은 흡광도 값을 가진 노란색으로 변하게 되고, 분광광도계는 보라색의 DPPH 라디칼을 확인하기 때문에 시료 내 DPPH 라디칼이 없으면 측정을 할 수 없다. 시료 내 DPPH 라디칼을 모두 소거하여 측정이 안된 농도를 살펴보면 70%에탄올 추출물은 50 μg/mL 이상, 열수 추출물은 100 μg/mL로 확인되었으며, 항산화 효과는 70% 에탄올 과피 추출물이 열수 과피 추출물보다 높다는 것을 간접적으로 알 수 있었다. 각 추출물은 농도가 증가함에 따라 DPPH 라디칼 소거활성은 증가하는 경향이었고, 각 추출물의 DPPH 라디칼 소거활성을 비교하였을 때, 12.5 μg/mL 농도에서 70% 에탄올 과피 추출물이 91.70%로 가장 효능이 높았으며, 항산화 활성은 과육보다 과피가 높았고, 추출방법은 70% 에탄올 추출이 높은 경향을 나타냈다.
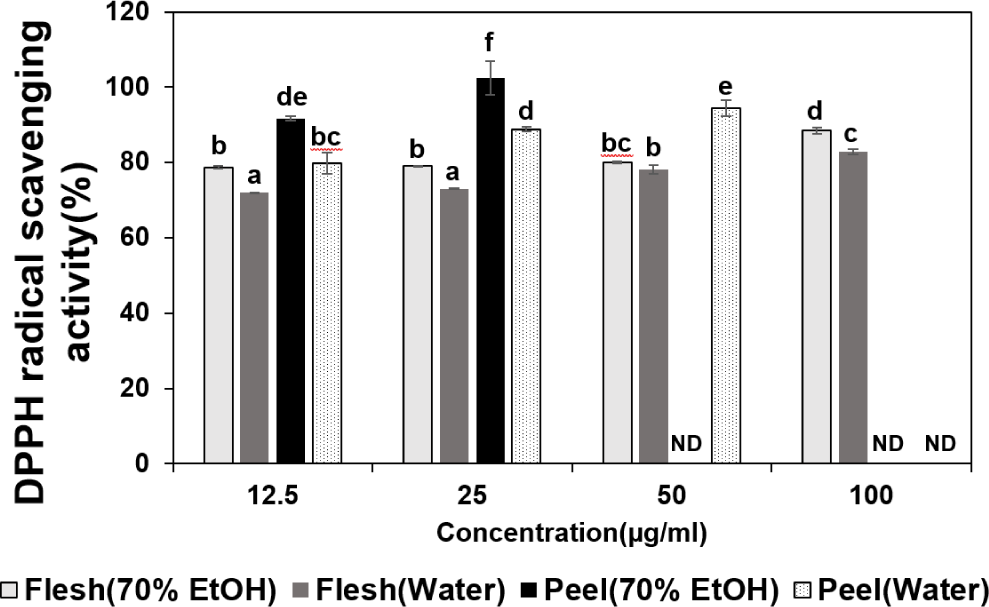
DPPH 라디칼 소거능의 경우 자유라디칼을 소거하는 반면, ABTS는 양이온 라디칼을 제거하는 차이를 가지기 때문에 기질과 반응물질과의 결합 정도가 달라져 라디칼 제거 능력의 차이를 보이지만(Li et al., 2007), 본 연구에서 항산화 효과 측정방법을 달리 하여도 항산화 활성은 70% 에탄올 과피 추출물이 가장 우수하였고, 부위별 항산화 활성은 과육보다 과피가 높고, 추출방법에 따른 항산화 활성은 70% 에탄올 추출물이 높은 경향은 유사하게 나타났다. 이러한 결과는 총 폴리페놀 함량과 항산화 효과가 밀접한 상관성을 갖는다는 보고(Anagnostopoulou et al., 2006)와도 부합하는 결과라고 여겨진다.
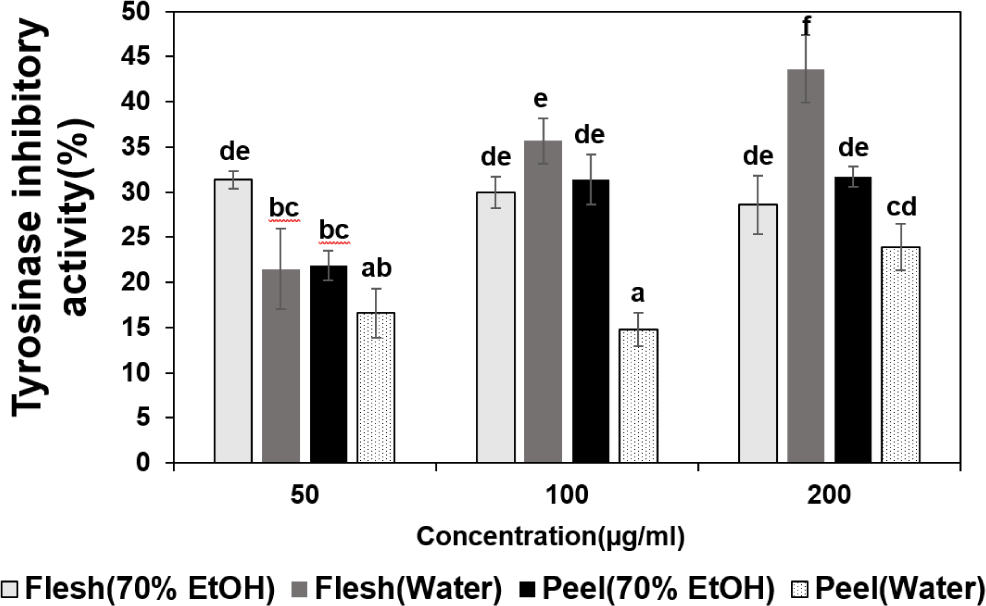
피부 세포 내 멜라닌은 과도한 자외선 노출에 따른 피부조직 유전자의 변형과 자외선의 체내 투과량을 감소시켜 피부를 보호하고, 피부암 발생을 억제하는 역할을 한다. 하지만 피부 내 과도하게 생성된 멜라닌은 색소침착을 야기시켜 기미, 주근깨, 검버섯뿐만 아니라 피부 노화의 원인 중 하나이다(Kwak et al., 2004). 멜라닌 생성 주요 효소인 타이로시나제는 티로신을 멜라닌으로 변환시키는 주요 효소이며, 피부의 멜라닌양이 증가하면 피부가 어두운 색으로 착색되어 타이로시나제는 피부 미백에 관련된 핵심적인 효소로 간주한다(Saeedi et al., 2021). 적색종 용과 추출물을 농도별로 처리한 후 타이로시나제 활성 저해 효과는 Fig. 3에 제시하였다. 타이로시나제 활성 저해 효과는 과피보다 과육이 높은 경향을 나타냈고, 과육 열수 추출물에서도 농도가 증가함에 따라 증가하는 경향을 나타냈다. 적색종 용과 부위 및 추출방법에 따른 추출물의 농도별 타이로시나제 활성 저해 효과는 저농도에서 무처리구 대비 과육 70% 에탄올 추출물이 가장 높았고, 고농도에서는 과육 열수 추출물이 가장 높게 나타났다. 이는 과육의 70% 에탄올과 열수 추출물의 타이로시나제 활성 저해 효과가 차이가 나타나는 것은 산복숭아 추출방법에 따라 타이로시나제 활성 저해 효과가 차이가 있다는 연구결과와 유사하였다(Kim et al., 2012). 과육 70% 에탄올 추출물은 처리 농도에 상관없이 타이로시나제 활성 저해 효과가 증감의 경향이 나타나지 않는 것으로 미루어 보아 50 μg/mL 농도에서 타이로시나제 활성 효과가 최대인 것으로 판단된다. 따라서 본 연구결과 적색종 용과 과육 추출물을 이용한 소재개발 시 비용과 생리활성 효능을 고려하여 경제적인 측면에서 과육 70% 에탄올 추출물을 활용하고, 고기능성을 고려할 경우 과육 열수 추출물을 이용하는 것이 효과적으로 사용될 수 있을 것으로 판단된다. 추후 적색종 용과 추출물의 타이로시나제 연관 단백질과 mRNA 등의 발현량을 통해 멜라닌 생성 억제 효과에 관한 분자생물학적 수준의 연구가 필요하다고 사료된다.
비만은 제2형 당뇨, 고혈압, 심혈관 질환 등 여러 만성질환과 관련된 가장 흔한 대사 질환으로, 지방세포의 분열 및 지방 전구세포로부터의 분화로 인해 지방세포가 과도하게 증가하여 나타난다(Ali et al., 2013). 지방전구세포는 높은 열량 섭취, 인슐린, 당질코르티코이드 등 다양한 자극인자들에 의해 지방세포로 분화한다(Berk et al., 2016). 과육의 70% 에탄올과 열수 추출물의 지방세포 분화 억제 실험을 위하여 MTT assay룰 통해 3T3-L1 세포에서 독성이 없는 농도를 먼저 확인했다(Fig. 4A). 3T3-L1 지방전구세포에 농도별 (31.25, 62.5, 125, 250, 500, 1,000 μg/mL)로 처리했을 때, 적색종 용과 과육 70% 에탄올, 열수 추출물은 250 μg/mL 농도까지 무처리군 대비 90% 이상의 세포생존율을 나타내어 독성이 나타나지 않는 것을 확인하였다. 이 결과를 바탕으로 과육의 70% 에탄올과 열수 추출물을 세포독성이 없는 62.5, 125, 250 μg/mL 농도로 지방세포분화 억제 실험을 진행하였다.
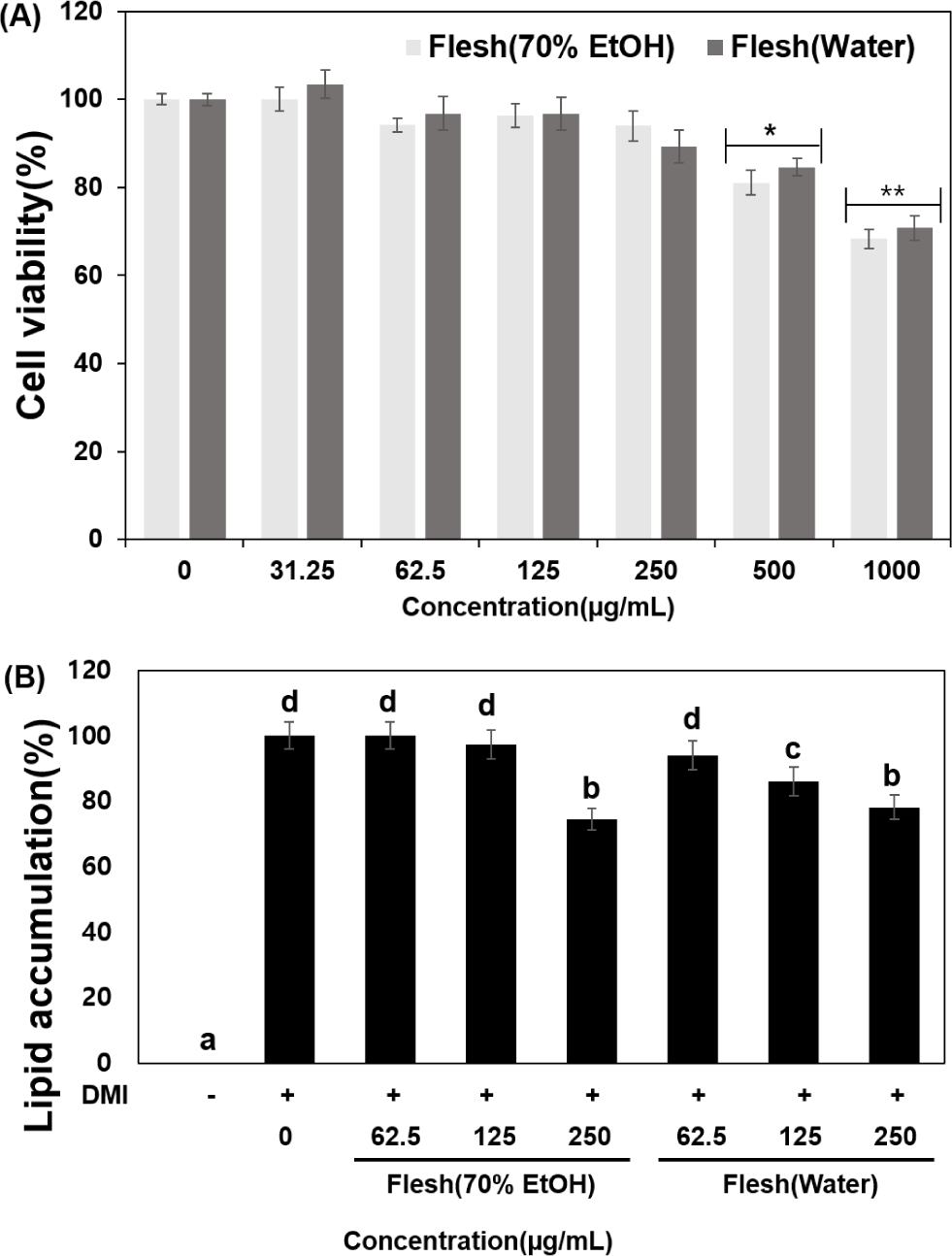
3T3-L1 지방전구세포는 분화유도물질(DMI; Dex, IBMX, Ins)이 첨가된 분화유도 배지에서 세포 내 지방 및 중성지방(triglyceride)이 축적되어 형태 변화가 관찰되면서 지방세포로 분화(differentiation)가 가능하며, 다양한 지방 생성 유전자들의 발현에 작용한다고 보고되었다(Rubin et al., 1978). 지방세포 내 중성지방 생성 억제는 항비만의 유의적인 지표로 알려져 있고, 중성지방을 특이적으로 염색하는 Oil-red O 염색법을 통해 항비만 효과를 측정하였다. 분화된 3T3-L1 지방세포에 과육의 70% 에탄올과 열수 추출물을 처리한 후 Oil-red O 염색으로 세포 내 생성된 중성지방 양을 측정했다(Fig. 4B). 과육의 70% 에탄올 추출물은 250 μg/mL 농도에서 지질축적률을 비교하였을 때 DMI 분화유도물질만 단독으로 처리한 대조군(100%)에 비해 지방축적이 74.38%로 유의적(p<0.05)으로 감소함을 관찰할 수 있었다. 과육의 열수 추출물은 처리농도 62.5, 125, 250 μg/mL에서 DMI 분화유도물질만 단독으로 처리한 대조군에 비해 지질축적률은 각각 93.99, 86.13, 78.08%로 농도 의존적으로 감소하였고, 과육 열수 추출물 125, 250 μg/mL 농도에서 지방축적이 유의적(p<0.05)으로 감소한 것을 확인하였다. 과육의 70% 에탄올과 열수 추출물은 250 μg/mL 농도에서 대조군에 비해 지방축적이 통계적으로 비슷하게 유의한 수준으로 감소하였지만, 열수 추출물의 경우 농도의존효과 측면에서 70% 에탄올 추출물보다 항비만 효과가 높다는 것을 간접적으로 알 수 있었다. 적색종 용과 “Jindu” 품종의 과육과 과피가 활성산소종의 생성을 억제함으로써 산화 스트레스를 조절하여 3T3-L1 세포에서 지방축적 감소 효과를 나타낸다는 보고(Khoo et al., 2022)와 유사하며, 이는 적색종 용과 과육 추출물이 항비만 소재로서 적합할 것으로 사료된다.
요 약
본 연구는 2019년 대만에서 도입된 적색종 용과의 생리활성 연구가 전무하여 제주산 적색종 용과 과육과 과피의 70% 에탄올과 열수 추출방법에 따라 제조한 추출물을 통한 항산화 효과와 미백 및 항비만 생리활성 효능을 확인함으로써 제주에서 재배되는 적색종 용과의 우수성을 과학적으로 입증하여 부가가치를 높이고, 기능성 식품 소재로서의 적용 가능성을 밝히고자 하였다. 항산화 물질(총 폴리페놀 함량)과 항산화 활성(ABTS 라디칼 소거능, DDPH 라디칼 소거능)은 70% 에탄올 과피 추출물이 가장 높았다. 미백 효과를 평가하기 위한 Tyrosinase 저해 활성 효과는 과육이 과피보다 효능이 우수하였고, 비용과 생리활성 효능을 고려하였을 때 경제적인 측면에서는 과육 70% 에탄올 추출물이 우수하고, 고기능성 미용 제품과 식품 소재 개발의 경우 과육 열수 추출물을 이용하는 것이 효과적으로 사용될 수 있을 것으로 판단된다. 항비만 효과를 평가하기 위해 적색종 용과 과육 추출물을 세포독성이 없는 농도에서 3T3-L1 지방세포분화 실험을 수행한 결과, 과육 열수 추출물이 대조구에 비해 농도 의존적으로 지방 축적이 유의적으로 낮은 함량을 나타내었다.
결론적으로 적색종 용과 과피 추출물의 항산화, 과육 추출물의 미백 및 항비만 효능을 확인하여 가장 효과적인 추출방법을 제시하였다. 향후 버려지는 과피와 비상품 과육을 활용해 자원으로서 활용가능성을 시사하며, 적색종 용과가 다양한 건강 기능성 식품 소재로 활용될 것으로 기대된다. 다만 항산화, 미백, 항비만 효능을 나타내는 기능성 물질 분석과 임상 연구 등 심도 있는 추가 연구가 필요할 것으로 판단된다.
