서 론
타라곤(Artemisia dracunculus L.)은 국화과(Asteraceae)에 속하는 다년생 허브로 식품의 풍미를 향상시키기 위한 조미료로 주로 이용되며 천연 향료 및 보존제의 원료로도 활용된다(Khajeh et al., 2025). 타라곤의 주요 성분은 정유(essential oil)로, 에스트라골, 유제놀, 헤르니아닌 등의 생리활성 화합물을 함유하고 있다(Obolskiy et al., 2011; Pujicic et al., 2025a). 이러한 화합물은 항산화, 항염, 항균 등의 생리활성을 지니며, 식품 및 제약 산업에서 기능성 소재로 활용된다(Attar, 2025).
최근 천연소재로부터 생리활성 화합물을 효율적으로 회수하기 위한 친환경 추출 기술이 주목받고 있다(Waseem et al., 2023; Herrero, 2024). 유기용매를 사용하는 전통 추출법은 다량의 용매를 필요로 하며, 잔류 용매로 인한 안전성 문제가 제기되고 있다. 또한, 낮은 선택성으로 인해 불순물이 함께 추출되어 추출물의 순도가 낮으며 유기용매의 회수 및 폐기 과정에서 높은 에너지와 경제적 비용이 발생하여 실용적 적용에 한계가 있다(Shahbaz et al., 2025; Sun et al., 2025). 따라서, 이러한 문제를 극복하기 위해 아임계수 추출과 초음파 보조 추출과 같은 녹색 추출 기술이 대안으로 활용되고 있다(Kutlu et al., 2022).
아임계수 추출(Subcritical-water extraction, SWE)은 100–374℃의 온도와 약 10 MPa의 압력 하에서 액체 상태의 물을 용매로 사용하는 기술이다. 온도가 증가함에 따라 물의 유전상수(dielectric constant)가 감소하므로, 아임계수 상태의 물은 상온의 물보다 극성이 낮다. 특히 100℃ 이상에서 유전상수가 점차 감소하며, 200℃에서는 메탄올 수준(ε≈33)의 극성을 나타낸다(Alghoul et al., 2017). 이러한 특성으로 인해 아임계수는 극성과 저극성 화합물 모두 추출할 수 있는 친환경 추출 기술로 평가된다(Essien et al., 2020).
초음파 보조 추출(ultrasound-assisted extraction, UAE)은 초음파의 공동현상(cavitation)으로 발생한 미세 기포의 붕괴를 통해 식물 세포벽을 파괴하고, 세포 내 생리활성 화합물을 용출하는 기술이다. 초음파는 20 kHz 이상의 기계적 진동을 통해 압축(compression)과 팽창(rarefaction)을 반복하며 액상에서 미세 기포를 형성한다(Sethi & Rathod, 2025). 이 과정에서 발생하는 공동현상은 용매의 침투를 촉진하고, 용질의 확산을 가속화하여 추출 효율을 향상시킨다. 이러한 특성으로 인해 초음파 보조 추출은 낮은 온도와 짧은 시간 조건에서도 높은 추출 효율을 달성할 수 있는 친환경 추출 기술로 평가된다(Pereira et al., 2025).
따라서, 본 연구에서는 타라곤에 함유된 주요 생리활성 화합물인 에스트라골, 유제놀, 헤르니아닌을 대상으로 아임계수 추출과 초음파 보조 추출을 적용하여 각 화합물의 추출 경향을 확인하고, 기존 유기용매 추출법과의 추출 효율을 비교하였다. 이를 통해 타라곤의 기능성 성분을 친환경적이고 효율적으로 회수할 수 있는 최적의 추출 조건을 도출하고자 하였다.
재료 및 방법
본 실험에 사용된 타라곤은 이란산 건조 타라곤(Shinyoung FS Co., Gwangju, Gyeonggi, Korea)으로, 수분 함량은 9.49±0.12%였다. 시료는 Philips 5000 Series Blender (Model HR3571; Koninklijke Philips N.V., Amsterdam, Noord-Holland, Netherlands)를 사용하여 425-1,000 µm 크기로 분쇄하였으며, 이를 추출에 사용하였다. 성분 분석에 사용된 표준물질은 에스트라골(≥98.0%), 유제놀(≥99.0%), 헤르니아닌(≥98.0%)이며, Sigma-Aldrich (St. Louis, MO, USA)에서 구입하였다. 에탄올, 메탄올과 헥세인은 Deoksan pure Chemicals (Ansan, Gyeonggi-do, Korea)에서 구매하였다.
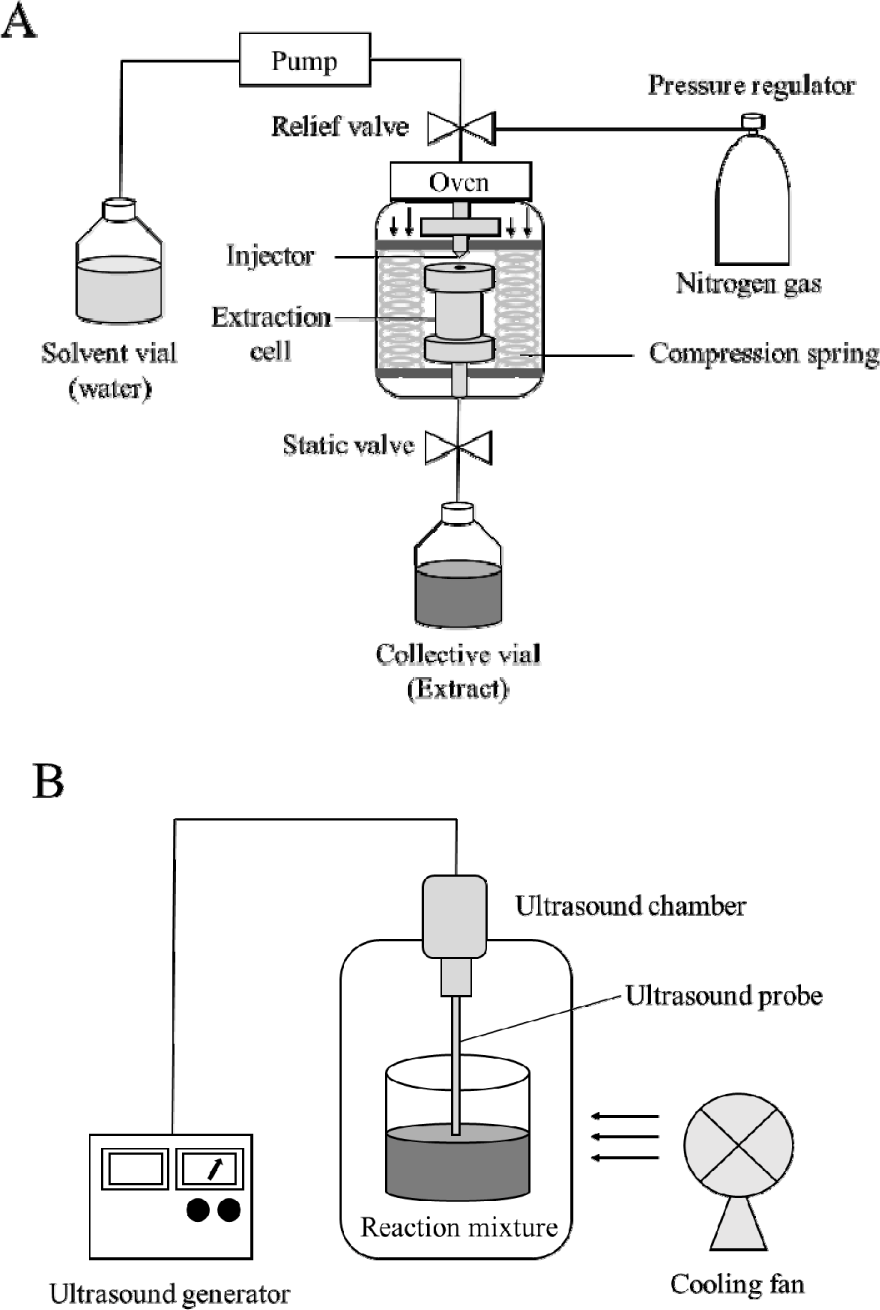
아임계수 추출은 가속 용매 추출기(ASE 350; Thermo Scientific, Sunnyvale, CA, USA)를 이용하여 수행하였으며, 아임계수 추출기의 모식도는 Fig. 1A에 나타냈다. 추출 시 타라곤 시료 1 g과 규조토 2 g을 혼합하여 사용하였으며, 혼합 시료는 셀룰로오스 필터(Whatman filter paper; Cytiva, Maidstone, Kent, UK)를 장착한 22 mL 스테인리스 추출 셀에 충진하였다. 추출 조건은 추출온도 110, 130, 150, 170, 190, 200℃ 및 추출시간 5, 10, 15분으로 설정하였고, 가열된 오븐 내에서 아임계수 추출을 진행하였다. 용매로는 증류수(RO Ele 10; Mirae ST, Anyang, Gyeonggi-do, Korea)를 사용하였으며, 추출 중 압력은 약 10 MPa로 유지하였다. 추출 후 약 1분간 질소 가스를 주입하여 잔류 용매를 제거한 뒤, 추출액을 유리 바이알에 수집하였다. 모든 실험은 3회 반복하였다.
얻어진 추출물은 헥세인 22 mL를 이용하여 액–액 추출(liquid–liquid extraction)을 수행하였고, 상층액을 분리하였다. 이후 원심분리기를 이용하여 불순물을 제거한 뒤, 0.45 µm 실린지 필터(polyvinylidene fluoride syringe filter; Whatman, Maidstone, Kent, UK)를 장착한 주사기를 사용하여 상층액을 여과한 후 분석용 바이알에 담았다.
초음파 보조 추출은 초음파 추출기(NE-500Z; Henan Chuanghe Laboratory Equipment Co., Ltd., Zhengzhou, Henan, China)를 사용하여 수행하였으며, 초음파 추출기의 모식도는 Fig. 1B에 나타냈다. 추출 시 타라곤 시료 1 g과 증류수 22 mL를 혼합하여 사용하였다. 본 장치는 최대 출력 500 W, 주파수 24 kHz에서 작동하며, 출력은 250, 350, 450 W로 설정하였다. 처리 시간은 5, 10, 15분으로 조절하였다. 온도 조절 기능이 장착되지 않은 장비를 사용하였으며, 초음파 처리 중 발생하는 열을 완화하기 위해 송풍 냉각 방식을 적용하여 시료의 온도 상승을 억제하였다. 이후 전처리 과정은 아임계수 추출물의 전처리 방법과 동일하게 수행하였다.
기존 유기용매 추출 및 열수 추출은 침용 추출법으로 수행하였다. 침용 추출은 Gerçek et al. (2023)의 방법을 일부 수정하여 진행하였다. 타라곤 시료 1 g과 용매 22 mL (80% 에탄올, 100% 메탄올, 또는 증류수)를 혼합하여 바이알에 넣고, 항온수조(C-WB; Changshin Scientific, Seoul, Korea)에서 추출하였다. 80% 에탄올 및 100% 메탄올 추출은 45℃에서 120분간, 열수 추출은 90℃에서 120분간 진행하였다. 추출 후 회전 증발 농축기(Rotavapor R-100; Buchi, Flawil, St. Gallen, Switzerland)를 이용하여 유기용매를 제거하였다. 이후 전처리 과정은 아임계수 추출물의 전처리 방법과 동일하게 수행하였다.
타라곤 추출물에 함유된 에스트라골, 유제놀, 헤르니아닌의 함량은 GC–FID 시스템(Model 8890; Agilent Technologies, Santa Clara, CA, USA)과 HP-5 컬럼(30 m×0.25 mm×0.25 µm; Agilent Technologies, Santa Clara, CA, USA)을 이용하여 정량 분석하였다. 컬럼 온도는 초기 50℃에서 2분간 유지한 후, 4℃/min의 속도로 250℃까지 승온하였으며, 최종 온도에서 5분간 유지하였다. 총 분석 시간은 57분이었다. 주입구와 검출기(FID)의 온도는 각각 250℃로 설정하였으며, 분할 주입 모드(split ratio 10:1)로 시료 1 µL를 주입하였다. 질소(N2)는 1.0 mL/min의 유속으로 캐리어 가스로 사용하였고, 수소(H2)와 공기(air)는 FID 검출기의 연소 가스로 공급하였다.
타라곤의 성분 함량은 표준물질의 검량선을 이용하여 정량하였다. 추출 온도와 시간은 유효 성분 함량이 가장 높게 나타난 조건을 기준으로 최적화하였으며, 결과는 평균±표준편차로 나타냈다. 통계 분석은 SPSS 프로그램(Statistical Package for the Social Sciences; SPSS Inc., Chicago, IL, USA)을 이용하여 수행하였고, p<0.05 수준에서 일원배치분산분석(one-way ANOVA) 후 Duncan의 다중범위검정(Duncan’s multiple range test)으로 유의차를 검정하였다. 모든 실험은 3회 반복하여 수행하였다.
결과 및 고찰
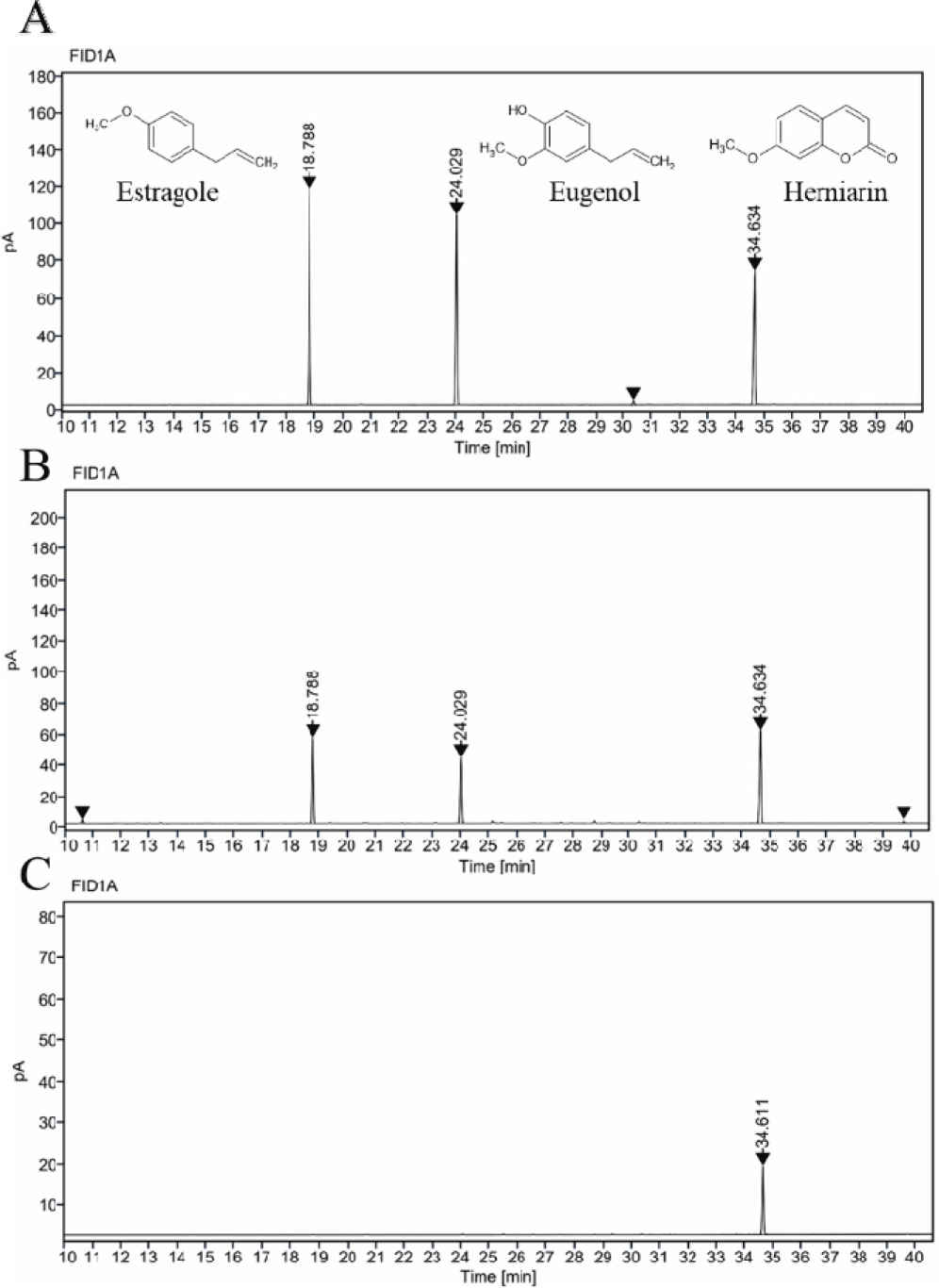
가스크로마토그래피 분석 결과, 타라곤 추출물의 주요 성분으로는 에스트라골, 유제놀, 헤르니아닌이 확인되었다. 세 화합물은 각각 0.25, 0.125, 0.0625, 0.03125, 0.015625, 0.007812 mg/mL의 농도로 헥세인에 희석하여 검량선을 작성하였다. 또한 0.25 mg/mL 농도의 표준용액과 아임계수 및 초음파 보조 추출물을 가스크로마토그래피로 분석하였으며, 결과는 Fig. 2에 나타내었다. 에스트라골, 유제놀, 헤르니아닌의 검출 시간은 각각 18.7, 24.0, 34.6분으로 나타났으며, 각 표준곡선의 회귀식은 y = 1,434x – 0.37 (R2=0.99), y = 1,518.6x – 0.73 (R2=0.99), y = 1,106.3x + 1.01 (R2=1.00)로 확인되었다.
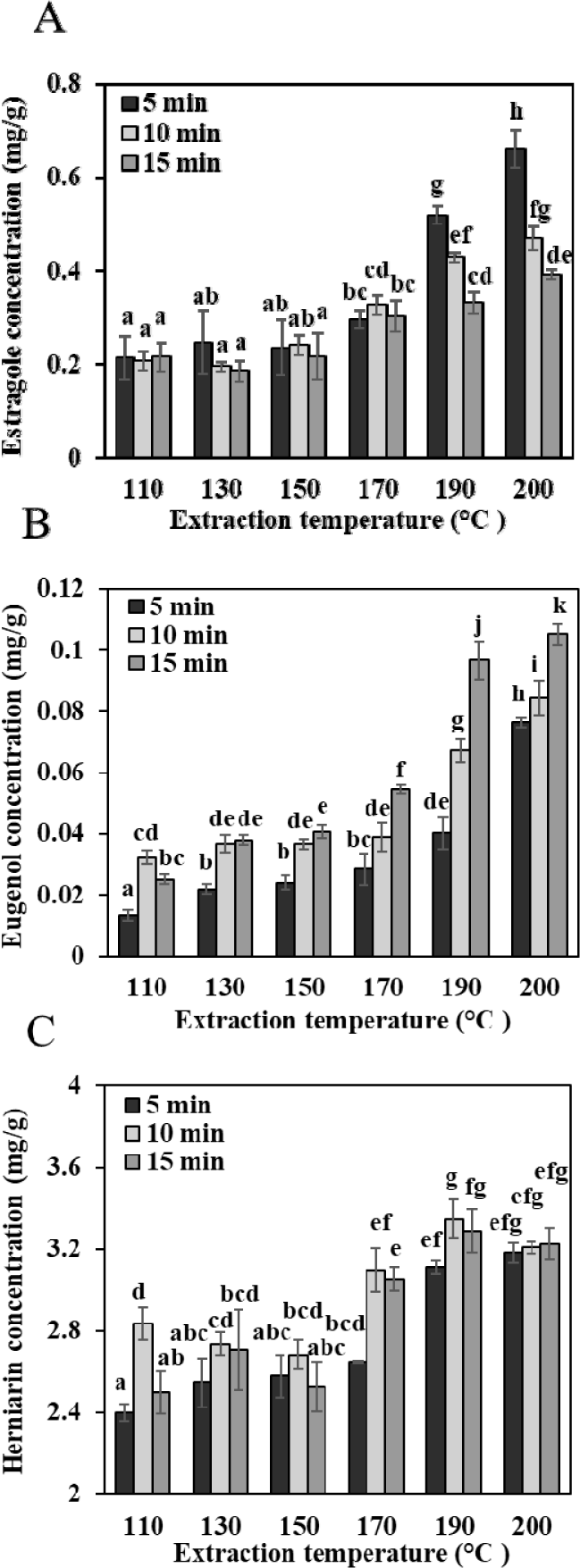
아임계수의 추출온도(110, 130, 150, 170, 190, 200℃)와 추출시간(5, 10, 15분)에 따른 타라곤 추출물의 추출 수율(Table 1)과 주요 성분인 에스트라골, 유제놀, 헤르니아닌의 함량 변화(Fig. 3)를 확인하였다.
아임계수 추출 수율(Table 1)은 추출 온도가 110℃에서 200℃로 상승함에 따라 증가하였으며, 200℃에서 10분 동안 추출했을 때 55.59±0.41%의 최대 수율을 나타냈다. 이러한 경향은 Miron et al. (2011)의 보고와 유사하며, 이는 고온 및 고압의 아임계수 추출 조건에서 식물 세포 내 유효성분의 용출이 촉진되었기 때문으로 판단된다.
에스트라골(Fig. 3A)의 최대 함량은 0.66±0.04 mg/g으로, 추출 조건은 200℃, 5분이었다. 에스트라골은 추출 온도가 110–150℃일 때 함량 변화가 크지 않았으나, 170℃ 이상에서 점차 증가하여 200℃에서 최대값을 나타냈다. Ferenc & Bocian (2000)은 방향족 고리에 결합된 메톡시기의 공명 효과가 전자 밀도를 증가시켜 분자의 열적 안정성을 높인다고 보고하였다. 따라서 메톡시기를 갖는 에스트라골 또한 고온 고압의 아임계수 조건에서 안정성을 보인 것으로 판단된다(Siano et al., 2003).
유제놀(Fig. 3B)의 최대 함량은 0.11±0.00 mg/g으로, 추출 조건은 200℃, 15분이었다. 특히 상대적으로 높은 추출온도(170~200℃)에서는 추출 시간이 길어질수록 함량이 증가하는 경향을 보였다. 유제놀은 분자 내 페놀기와 알릴기 구조로 인해 비교적 열에 안정적이며, 약 205℃ 이상에서 열분해가 시작된다고 알려져 있어, 아임계수의 비교적 높은 온도에서도 안정적으로 추출된 것으로 보인다(Matykiewicz & Skórczewska, 2022).
헤르니아닌(Fig. 3C)의 최대 함량은 3.35±0.09 mg/g으로, 추출 조건은 190℃, 10분이었다. 추출 온도 상승에 따른 함량 변화는 크지 않았으며, 190℃에서 최대값을 나타낸 후 200℃ 이상에서는 감소하는 경향을 보였다. 헤르니아닌은 쿠마린의 탄소가 메톡시기로 치환된 구조이다. Doctor et al. (2020)에 따르면, 쿠마린은 200℃ 이하의 아임계수 조건에서 90% 이상의 회수율을 보였으며, 뚜렷한 분해산물은 관찰되지 않았다. 또한, 헤르니아닌의 메톡시기는 구조적으로 안정적이다(Donovalová et al., 2012; Khemakhem et al., 2013). 따라서 쿠마린 골격을 가진 헤르니아닌은 190℃의 고온의 추출 조건에서도 안정적으로 추출된 것으로 판단된다.
초음파 출력(250 W, 350 W, 450 W)과 시간(5, 10, 15분)에 따른 타라곤 추출물의 에스트라골, 유제놀, 헤르니아닌 함량 변화를 분석하였다. 에스트라골과 유제놀은 모든 초음파 보조 추출 조건에서 검출되지 않았으며, 따라서 Fig. 4에는 헤르니아닌 함량 변화만을 나타내었다. 에스트라골과 유제놀은 비교적 저극성 화합물로서 물 만을 용매로 사용한 초음파 보조 추출에서는 용출되지 않은 것으로 판단된다. 반면, 헤르니아닌은 초음파 보조 추출물에서 검출되었는데, 이는 헤르니아닌의 쿠마린 구조가 친수성 방향족 락톤으로 분류되어 물에서 추출되는 것으로 사료된다(Paulsen et al., 2010).
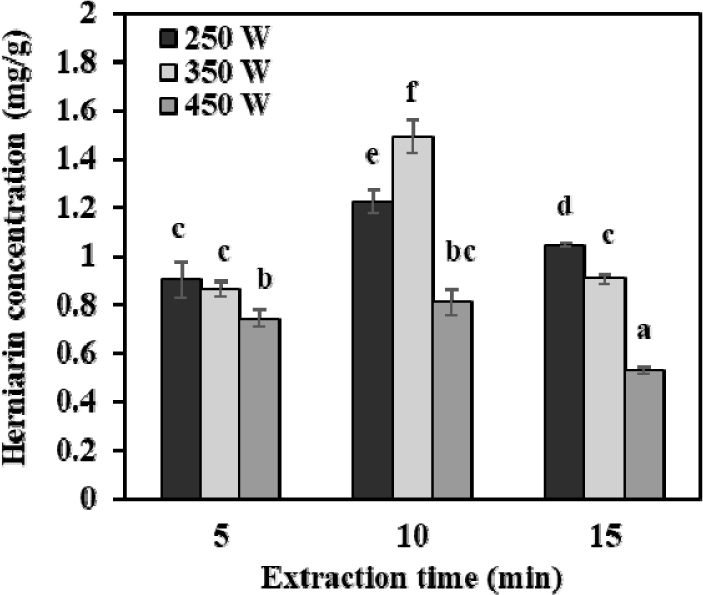
헤르니아닌의 최대 함량은 1.49±0.07 mg/g으로, 추출 조건은 350 W, 10분이었다. 초음파 출력이 250 W에서 350 W로 증가함에 따라 함량이 상승하였으나, 450 W에서는 감소하는 경향을 보였다. Kutlu et al. (2022)은 초음파 보조 추출 시 출력 증가에 따라 공동현상(cavitation)이 강화되어 세포벽이 파괴되고, 이로 인해 내부 성분의 용출이 촉진된다고 보고하였다. 그러나 과도한 출력은 국소적으로 초고온과 초고압을 형성할 수 있어, 활성 성분의 열적 분해를 유발할 수 있다(Kumar et al., 2021). 따라서 본 연구에서 헤르니아닌은 350 W, 10분 처리 조건에서 세포 구조 파괴와 화합물의 열적 안정성 간 균형이 가장 적절히 유지되어 최대 함량이 추출된 것으로 판단된다.
최적 추출 조건에서 얻은 아임계수 추출물과 초음파 보조 추출물의 에스트라골, 유제놀, 헤르니아닌 함량을 침용 추출물과 비교하였다(Table 2). 침용 추출에는 80% 에탄올(45℃, 120분), 100% 메탄올(45℃, 120분), 그리고 열수(90℃, 120분)를 용매로 사용하였다.
에스트라골은 저극성 화합물로, 물만을 사용한 초음파 보조 추출과 열수 추출에서는 검출되지 않았다. 반면, 아임계수 추출에서는 검출되었는데, 이는 고온 조건에서 물의 유전상수가 감소하여 극성이 낮아지고 결과적으로 저극성 화합물의 용출이 용이해지기 때문이다(Somat et al., 2025). 80% 에탄올 및 100% 메탄올 추출물에서는 각각 0.17±0.02 mg/g, 0.37±0.05 mg/g이 검출되었으며, 아임계수 추출물(0.66±0.04 mg/g)에서 가장 높은 함량을 나타냈다. 따라서 아임계수 추출은 저극성 화합물인 에스트라골의 회수에 가장 효과적인 추출 방법으로 판단된다.
유제놀은 아임계수 추출물에서 0.11±0.00 mg/g으로 검출되었으나, 다른 모든 추출법에서는 검출되지 않았다. 선행연구에서도 타라곤의 유기용매 추출에서 유제놀은 검출되지 않았으며, 이는 타라곤 내 유제놀 함량이 약 1% 수준으로 매우 낮기 때문으로 보인다(Ávila et al., 2023; Nikitin et al., 2023; Pujicic et al., 2025b). 아임계수 조건에서는 물의 표면장력이 감소하고 세포벽 구조가 약화되어 용매가 조직 내부로 더 쉽게 침투하며, 이로 인해 내부 화합물의 용출이 촉진되는 것으로 알려져 있다(Díaz-Reinoso et al., 2023). 그러므로 아임계수 추출의 물리적 특성이 타라곤 세포 내 유제놀의 방출을 촉진하여, 다른 추출법에서는 검출되지 않았던 유제놀이 소량 검출된 것으로 사료된다.
헤르니아닌은 모든 추출법에서 검출되었으며, 아임계수 추출물(3.35±0.09 mg/g)이 가장 높은 함량을 보였다. 다음으로 열수 추출물(1.59±0.04 mg/g)과 초음파 보조 추출물(1.49±0.07 mg/g)이 유사한 수준을 나타냈다. 80% 에탄올(1.20±0.04 mg/g)과 100% 메탄올(0.14±0.01 mg/g) 추출물에서도 검출되었다.
요 약
본 연구에서는 친환경 추출 기술인 아임계수와 초음파 보조 추출을 이용하여 타라곤에 함유된 에스트라골, 유제놀, 헤르니아닌을 추출하였다. 또한 침용 추출법(80% 에탄올, 100% 메탄올, 열수)을 통해 생리활성 화합물의 함량을 비교 분석하였다. 에스트라골은 170℃ 이하에서는 함량 변화가 크지 않았으나, 그 이상의 온도에서 급격히 증가하여 200℃에서 최대 함량을 나타냈다. 유제놀은 온도 상승에 따라 점진적으로 증가하였으며, 170℃ 이상에서는 추출 시간이 길어질수록 함량이 높아졌다. 헤르니아닌은 190℃에서 최대 함량을 보였고, 조건 변화에 따른 함량 차이는 크지 않았다. 세 성분 모두 열에 안정한 구조적 특성을 지니며, 고온의 아임계수 조건에서 최대 함량을 나타냈다. 초음파 보조 추출에서는 헤르니아닌만 검출되었으며, 출력이 증가함에 따라 함량이 증가하다가 350 W에서 최대값을 보인 후 감소하는 경향을 보였다. 침용 추출에서는 유제놀이 검출되지 않았고, 에스트라골과 헤르니아닌이 소량 검출되었다.
다양한 추출법과 비교한 결과, 아임계수 추출법에서 에스트라골, 유제놀, 헤르니아닌의 유효성분 함량이 가장 높게 나타났다. 따라서 아임계수 추출은 유기용매를 사용하지 않으면서 비교적 짧은 추출시간 내에 생리활성 화합물을 효율적으로 추출할 수 있는 친환경 추출기술임을 확인하였다. 본 연구 결과는 지속가능한 친환경 추출기술의 개발 뿐만 아니라, 기능성 식품 소재의 산업적 응용 가능성 확대에도 기여할 것으로 판단된다.
